2025년 Science:In vivo CAR T cell generation to treat cancer and autoimmune disease
페이지 정보
작성자 PnH 조회23회 작성일 25-07-08 15:41본문
2022년 초, 펜실베이니아 대학교 연구진은 Science 저널[1]에 주요 연구 논문을 게재했습니다. 이 논문은 생체 내(in vivo)에서 CAR-T 세포를 생성하는 새로운 기술(in vivo CAR-T)을 개발하는 내용입니다. 이 기술은 지질 나노입자(LNP)를 주입하여 mRNA를 전달하고, T 세포가 심장 섬유증 세포를 인식하도록 생체 내에서 재프로그램하여 심장 섬유증을 치료하는 방식입니다. 이 방법은 mRNA 백신과 유사하며, 간단한 주입만으로 생체 내에서 CAR-T 세포 치료제를 생성할 수 있습니다. 이는 복잡한 공정, 긴 사이클, 높은 가격 등 기존 CAR-T 세포 치료제의 핵심적인 문제점을 해결할 것으로 기대됩니다.
연구팀은 캡스턴 테라퓨틱스(Capstan Therapeutics)라는 회사를 설립했습니다. 이 회사는 체내 CAR-T 기술을 암, 자가면역 질환 , 섬유화 질환 치료에 적용을 집중적으로 연구했습니다. 현재 캡스턴 테라퓨틱스는 여러 제약 대기업과 벤처 캐피털 기관으로부터 3억 4천만 달러의 투자를 유치했습니다. 이 회사의 창립 멤버로는 칼 준(CAR-T 세포 치료의 선구자), 드류 와이스먼(노벨상 수상자이자 mRNA 기술 창시자), 조나단 엡스타인(체내 CAR-T 기술 발명자)이 있습니다.
캡스턴은 2025년 6월 11일 CAR-T 세포 치료제 CPTX2309(항-CD19 생체 내 CAR-T)가 B세포 매개 자가면역 질환 치료를 위한 1상 임상 시험을 공식적으로 시작했다고 발표했습니다.
2025년 6월 19일, Capstan과 펜실베이니아 대학의 연구진은 Science 저널에 "암과 자가면역 질환을 치료하기 위한 생체 내 CAR T 세포 생성" 이라는 제목의 연구 논문을 발표했습니다 [2].
연구팀은 독자적인 표적 지질 나노입자(tLNP)는 CAR mRNA를 체내 CD8 + T 세포에 성공적으로 전달하여 암 및 자가면역 질환에 대한 우수한 치료 가능성과 안전성을 보여주었습니다.
2017년 이후 미국 FDA는 다양한 B세포 악성 종양 치료를 위해 6개의 CAR-T 세포 치료제를 승인했습니다 . 또한, 전 세계적으로 수백 개의 자가 및 동종이계 CAR-T 세포와 CAR-NK 세포 치료제가 임상시험에 참여하고 있습니다.
이러한 체외 세포 치료법은 진행성 및 내성 암 환자에게 지속적인 반응을 제공하는 데 있어 주목할 만한 성공을 거두었습니다. 그러나 CAR-T 세포 치료법의 임상 적용은 제조상의 어려움(비용, 시간 및 규모), 지리적 제한, CAR-T 세포 치료를 수행할 수 있는 전문 의료 센터의 수 제한, 림프구 감소 화학 요법의 필요성, 바이러스 벡터의 잠재적 안전 문제로 인해 심각하게 제한됩니다.
최근 CAR-T 세포 치료법은 B세포 매개 자가면역 질환 치료에 큰 잠재력을 보여주었습니다. B 세포 전신성 홍반 루푸스 , 근염, 전신 경화증, 중증 근무력증 과 같은 질환에서 유의미하고 지속적인 임상적 이점을 입증했습니다 .
이러한 자가면역 질환의 환자 수 는 B세포 악성 종양보다 훨씬 많으며, 미국에서만 2천만 명의 환자가 있고 전 세계 인구의 약 10%가 어떤 형태로든 자가면역 질환을 앓고 있습니다. 이처럼 많은 환자 수에 직면하여, 확장 가능하고 기성품이며, 세포 및 바이러스 벡터를 사용하지 않고, 화학요법 전처리가 필요 없으며, 비전문 의료기관에서도 투여 가능한 새로운 치료법이 필요합니다. 림프구 감소 화학요법이 필요 없는 체내 CAR-T 기술은 이러한 요건을 충족할 것으로 예상됩니다.
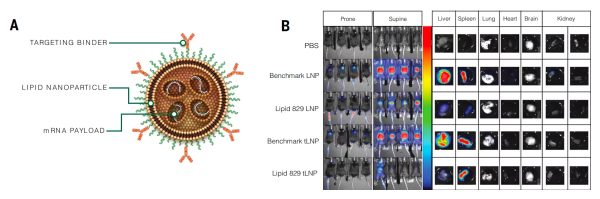
이번 최신 연구에서 연구팀은 새로운 이온화 가능 지질 L828을 개발하고 LNP 제형을 최적화하여 새로운 표적 지질 나노입자(tLNP)를 개발했습니다. tLNP의 간 축적은 현저히 감소했습니다. tLNP 표면에 항-CD5 항체를 결합함으로써 비장 면역 세포에 대한 특이적 표적화가 더욱 달성되었습니다.
자가면역 질환에서 CD4 + CAR - T 세포는 부작용을 일으킬 수 있습니다. 또한, CD4 + CAR - T 세포는 사이토카인 방출 증후군(CRS)의 주요 원인입니다. 연구팀은 CD8 + T 세포 를 특이적으로 표적화하기 위해 항-CD8 항체와 L829-LNP를 결합했습니다. 그 결과, 인간화 마우스 모델에서 CD8-L829-tLNP는 CD4 + T 세포보다 인간 CD8 + T 세포를 형질 전환하는 경향이 더 높았습니다. CD8-L829-tLNP는 항-CD19 CAR mRNA를 전달하여 혈액, 비장, 골수, 림프절에서 CD8 + T 세포를 빠르게 형질 전환할 수 있었으며 , 항원 특이적 세포독성, 증식 및 사이토카인 생성을 나타냈습니다.
또한 연구팀은 항-CD19 CAR mRNA의 비코딩 영역(UTR)과 코돈을 최적화하고, 더 높은 발현 수준과 종양 세포 사멸 효과를 갖는 최적화된 CAR2 시퀀스를 설계했습니다.
다음으로, 연구팀은 검증 실험을 수행했습니다. 연구팀은 자가면역 질환 환자와 건강한 공여자로부터 말초혈액 단핵세포(PBMC)를 확보했습니다. 그 결과, 두 공여자의 CD8+ T 세포는 표현형이 유사했으며, CD8-L829-tLNP에 의해 모두 CAR-T 세포로 형질전환되었습니다. 또한, 자가면역 질환 환자로부터 형질전환된 CAR-T 세포는 자신의 B 세포를 효과적으로 사멸시킬 수 있었습니다.
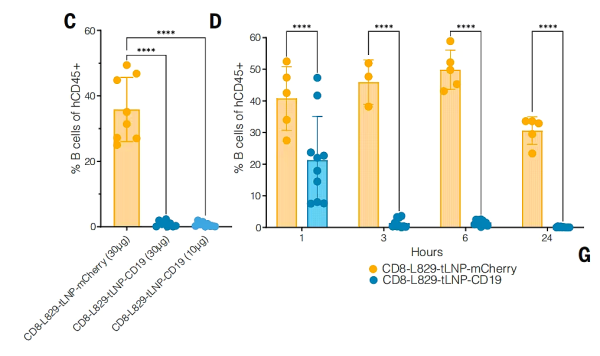
연구팀은 생체 내 치료 효과를 더욱 평가하기 위해 인간 말초혈액 단핵세포(PBMC)를 면역결핍 마우스에 이식하여 인간화된 마우스 모델을 구축했습니다. 그런 다음 10mg 또는 30mg의 CD8-L829-tLNP-CD19를 정맥 주사했습니다 . 그 결과, 마우스의 비장에서 B 세포가 1시간 후 감소하기 시작했고 3시간 후에는 비장에서 B 세포가 거의 완전히 제거되었지만 대조군에서 tLNP를 처리한 마우스는 그렇지 않았습니다. 그리고 CAR 발현은 주로 CD8 + T 세포에서 관찰되고 CD4 + T 세포 에서는 발현이 거의 발견되지 않았습니다 . 연구팀은 마우스에게 3일마다 30마이크로그램의 CD8-L829-tLNP-CD19를 총 3회 주사했고 첫 번째 주사 후 최대 14일 동안 빠르고 지속적인 B 세포 고갈을 보였다는 것을 추가로 확인했습니다.
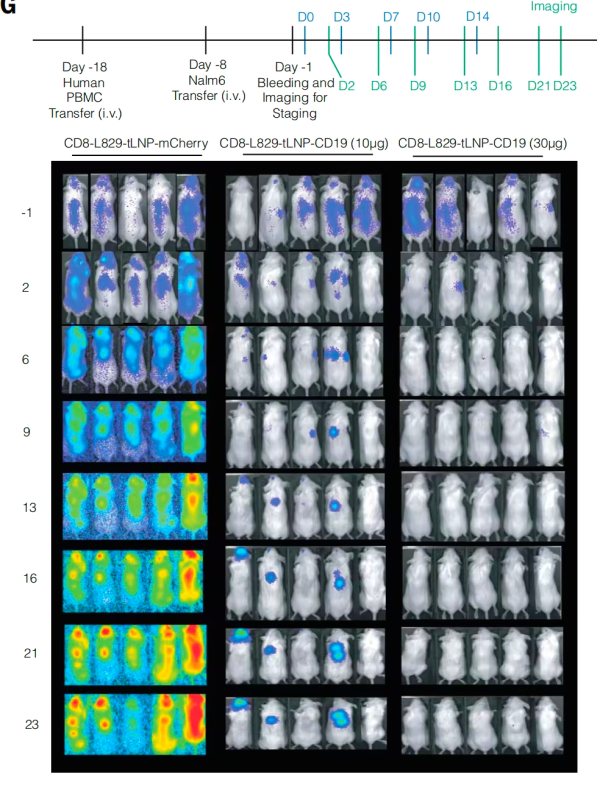
연구팀은 생체 내 종양 치료 효과를 검증하기 위해 인간화 백혈병 이종이식 마우스 모델을 제작한 후, 이 마우스들에게 10마이크로그램, 30마이크로그램의 CD8-L829-tLNP-CD19 치료군, 또는 30마이크로그램의 CD8-L829-tLNP-mCherry 대조군을 주 2회, 총 5회 투여했다. 그 결과, 대조군과 비교했을 때 10마이크로그램 투여량이 종양 억제에 유의미한 효과를 보였고, 30마이크로그램 투여량은 첫 번째 투여 후 2일 이내에 5마리 중 4마리의 마우스에서 종양이 거의 완전히 소실되었으며, 두 번째 투여 후 3일 이내에 모든 마우스에서 종양이 완전히 소실되었습니다.
이러한 결과는 CD8-L829-tLNP-CD19가 생체 내에서 기능적 CAR-T 세포를 효과적으로 생성할 수 있으며, 이러한 CAR-T 세포가 생체 내에서 B 세포를 제거하고 B 세포 종양을 제거할 수 있으며, 암과 자가면역 질환의 치료에 잠재적인 응용 가치가 있음을 나타냅니다.
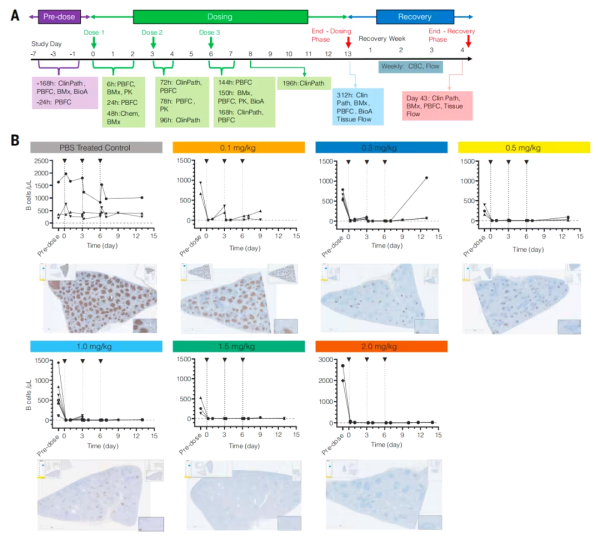
연구팀은 중개적 연관성이 있는 동물 모델에서 생체 내 CAR-T 치료의 효능과 안전성을 평가하기 위해 비인간 영장류 모델인 사이노몰구스 원숭이를 대상으로 연구를 수행했습니다. 그러나 사이노몰구스 원숭이의 B 세포를 표적으로 하기 위해 연구팀은 CD19가 아닌 CD20 표적을 사용했고, CD8-L829-tLNP를 사용하여 서열 최적화된 CD20 CAR mRNA를 전달했습니다. 시험관 내 실험 결과, CD8-L829-tLNP-CD20은 사이노몰구스 원숭이 T 세포를 효과적으로 변형시켜 인간 또는 사이노몰구스 원숭이 CD20을 발현하는 세포주를 표적으로 삼아 제거할 수 있음을 보여주었습니다.
연구팀은 22마리의 사이노몰구스 원숭이를 대상으로 추가 실험을 진행했습니다. 원숭이들에게는 72시간마다 체중 0.1~2.0mg/kg의 용량 범위로 CD8-L829-tLNP-CD20을 정맥 주사하여 총 3회 주사했습니다. 전반적으로 치료는 잘 견뎌냈지만, 체중 1.5mg/kg 용량군에서 한 마리의 사이노몰구스 원숭이가 엎드린 자세를 취하고 활동성이 감소하며 세 번째 투여 후 72시간 후에 저체온증을 보였습니다. 검사 결과, 면역 효과 세포 관련 혈구탐식성 림프조직구증 유사 증후군(CAR-T 세포 치료의 알려진 부작용)이 발생한 것으로 나타났습니다. 효과 측면에서, 치료 후 사이노몰구스 원숭이의 혈액과 조직에서 B 세포의 깊고 일시적인 고갈이 관찰되었습니다. 말초 혈액의 B 세포는 21일째에 다시 나타나기 시작하여 35일째에 거의 기준 수준으로 돌아왔습니다. 기억 B 세포가 거의 완전히 제거되었고, 치료 후 다시 나타난 B 세포는 대부분 사멸 세포였으며, 이는 면역 체계가 재설정되었음을 시사합니다.
이를 바탕으로 연구팀은 2회 투여 요법을 검토했습니다. 비교 결과, 2회 투여 요법은 비슷한 효과를 보였고, 우수한 안전성과 내약성을 보였으며, 3차 투여 후 IL-6 수치 증가와 같은 잠재적 위험을 피할 수 있었습니다.
전반적으로, 이 연구는 CD8-L829-tLNP를 이용한 CAR mRNA 전달을 기반으로 하는 생체 내 CAR-T 기술이 인간화된 마우스 모델과 비인간 영장류 모델에서 T 세포를 우선적으로 변형시켜 B 세포를 빠르고 깊게 제거함으로써 면역 재설정을 유도하고 지속적인 치료적 이점을 제공하며, B 세포 악성 종양과 자가면역 질환에 대한 CAR-T 세포 치료를 위한 새로운 솔루션을 제공한다는 것을 보여줍니다.
https://www.science.org/doi/10.1126/science.abm0594
https://www.science.org/doi/10.1126/science.ads8473
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.