네이처 나노테크놀로지(Nature Nanotechnology) 에 게재된 논문에 따르면 암세포는 실제로 세포간 나노튜브를 통해 면역 세포의 미토콘드리아를 이용하여 스스로를 면역력을 강화시킬 수 있다는 사실이 밝혀졌습니다.
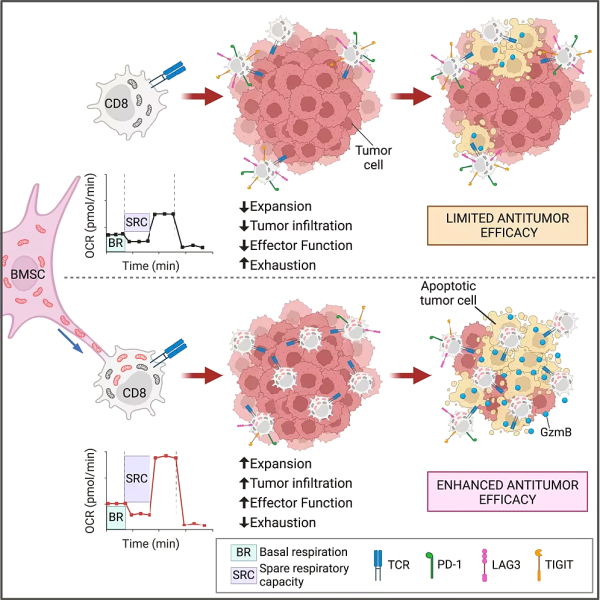
연구원들은 골수 간질 세포(BMSC)가 CD8 + T 세포와 나노튜브 연결을 설정하여 미토콘드리아를 T 세포로 전달할 수 있다는 사실을 발견했습니다.
외부 미토콘드리아 과충전을 획득한 T 세포는 풍부한 에너지를 갖고 있어 종양 미세환경에서 보다 안정적인 증식 특성과 침투 효율을 나타내며, 고갈될 가능성이 적습니다.
종양 치료의 어려움은 종종 가혹한 종양 미세 환경에서 비롯됩니다. T 세포와 같은 면역 세포의 경우 종양 미세 환경은 실제로 살기에 적합한 장소가 아닙니다. 다양한 부작용으로 인해 미토콘드리아 손상이 발생하고 T 세포 고갈이 발생할 수 있습니다. 미토콘드리아 자체도 상대적으로 취약한데, 미토콘드리아 DNA는 핵 DNA에 비해 손상이 축적될 가능성이 더 높으며, 그 기능도 연령과 다양한 치료 요인에 더 취약합니다.
핵심 에너지 공장인 미토콘드리아가 없으면 T 세포가 제 역할을 제대로 수행하지 못하는 것은 당연한 일입니다.
그렇다면 T세포를 재충전할 수 있는 방법은 없을까?
연구자들은 골수 간질 세포(BMSC)를 염두에 두었습니다. 이전 연구에서는 BMSC가 T 세포 기능과 분화를 조절할 수 있다는 사실을 발견했습니다. 연구자들은 이 둘 사이의 상호 작용에서 몇 가지 단서를 찾을 수 있을 것으로 추측합니다.
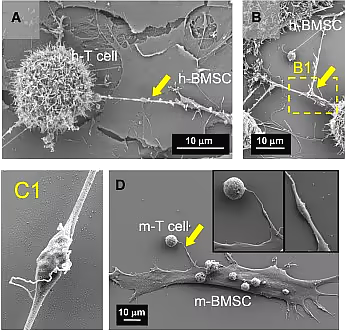
연구진은 일치하는 CD8 + T 세포 와 인간 또는 마우스 BMSC를 24시간 동안 공동 배양한 후 고정된 세포를 전계 방출 주사 전자 현미경(FESEM)으로 검사했습니다. 2021년 연구에도 이 초고화질 현미경을 사용했습니다.
연구진은 현미경을 통해 실제로 BMSC와 T 세포 사이에 세포당 평균 1개의 복잡한 나노튜브 브리지 구조가 있음을 관찰했습니다. 연구진은 세포가 고정될 때 초미세 구조가 손상되는 점을 고려하면 실제 나노튜브의 개수는 더 많아야 한다고 연구진은 믿고 있습니다.
흥미롭게도 나노튜브의 평균 폭은 1μm(마우스), 2μm(사람) 미만이지만, 내부에 무언가를 감싸고 있는 것처럼 부분적으로 팽창된 구조를 관찰할 수 있습니다.
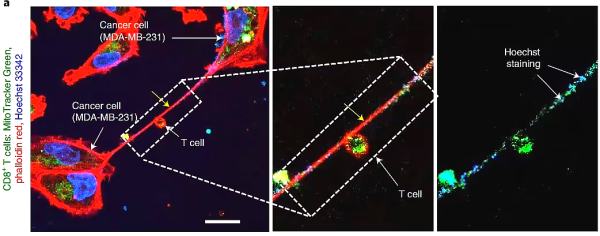
형광 단백질을 사용하여 미토콘드리아에 라벨을 붙인 결과, 이 확대된 부분이 BMSC에서 T 세포로 운반되는 미토콘드리아라는 것이 밝혀졌습니다.
에너지 공급을 받은 T세포가 더욱 강해졌습니다.
연구진은 먼저 T세포의 유산소 호흡 수준을 측정한 결과, 미토콘드리아 공급을 받은 후 T세포의 대사 능력이 강해지고 대사 활성이 크게 증가한다는 사실을 발견했습니다.
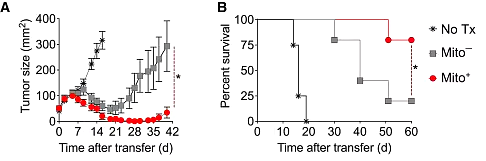
이는 CD8 + T 세포 의 항 종양 면역을 상당히 증가시킵니다 . 연구진은 T 세포를 흑색 종 B16 종양이 있는 쥐에 이식한 결과 과충전된 T 세포(미토 세포)가 더 강한 항종양 효과를 갖고 쥐의 생존 기간이 상당히 연장된다는 사실을 발견했습니다.
미토 세포는 또한 종양 미세환경에 의해 패배할 가능성이 적습니다. 이식 후 7일이 지나도 미토 세포는 대사 특성에 큰 변화 없이 여전히 높은 대사 이점을 유지할 수 있습니다.
이식이 완료된 지 한 달 뒤 연구진은 미토세포에 의해 확장된 자손세포를 분석한 결과, BMSC에서 나온 미토콘드리아가 반복적인 분열을 통해 자손에게 전달될 수 있다는 사실을 발견했으며, 자손세포의 미토콘드리아 함량이 여전히 높은 수준을 유지하고 있음을 보여주고있습니다.
마지막으로 연구진은 CD19-CAR-T 세포에서 과급 효과를 테스트했습니다. 그림에서 알 수 있듯이 NALM6-GL 백혈병 세포에 대한 6차례의 테스트 모두에서 미토 세포는 마지막 라운드까지 강력한 살상력을 유지한 반면, 충전되지 않은 T 세포(Mito-)는 3라운드부터 힘을 잃기 시작했습니다.
종양이 있는 쥐를 대상으로 한 실험에서도 비슷한 결과가 관찰되었습니다.
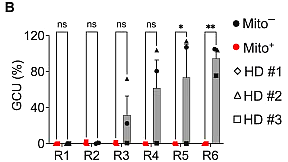
NALM6-GL 백혈병 세포에 대한 초강력 T 세포의 살상 능력 테스트
실험에서 연구진이 사용한 충전 방법은 T 세포를 BMSC와 공동배양하는 것이었습니다. 연구진은 미토콘드리아를 효과적으로 전달하기 위해 기증자 세포와 수용자 세포 모두 세포골격 단백질 Talin2를 발현해야 하며, 이는 연구자가 보다 표적화되고 효율적인 충전 솔루션을 설계하는 데 도움이 될 수 있음을 발견했습니다.
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.