2021년 최초 TCR 치료제 FDA 승인
페이지 정보
작성자 PnH 조회160회 작성일 24-05-17 13:42본문
세계 최초 T 세포 (TCR) 치료제 Kimmtrak(tebentafusp) 전이성 포도막 흑색종치료에 FDA승인
Tebentafusp는 항 -CD3면역 이펙터 도메인에 융합된 가용성 TCR로 구성된 새로운 T- 세포 수용체 (TCR) 이중 특이성 면역 치료 입니다.
양성 절제 불가능 또는 전이성 포도막 흑색종 (mUM) 성인 환자 의 치료를 위해
Kimmtrak(tebentafusp-tebn, IMCgp100)을 미국 식품의약국( FDA )에서 승인했다고 발표했습니다.
Kimmtrak 의 승인으로
(1) FDA 규제 승인을 받은 최초의 TCR 요법입니다
(2) 고형 종양 치료를 위한 이중특이성 T 세포 참여를 승인받은 최초의 FDA 규제 승인
(3) 절제 불가능하거나 전이성 mUM에 대한 최초이자 유일한 FDA 승인 치료입니다..
포도막 흑색종 (UM)은 생존율이 낮고 매우 공격적이고 파괴적인 질병으로, 역사적으로 전이 1년 이내에
많은 환자가 사망했습니다. 전이성 질환이 있는 환자의 예후는 좋지 않으며 상황은 수십 년 동안 크게
개선되지 않았습니다.
Kimmtrak의 승인은 전이성 포도막 흑색종 (mUM) 치료의 주요 패러다임 변화를 나타내며
이러한 고형암 환자에게 희망을 가져다줍니다.
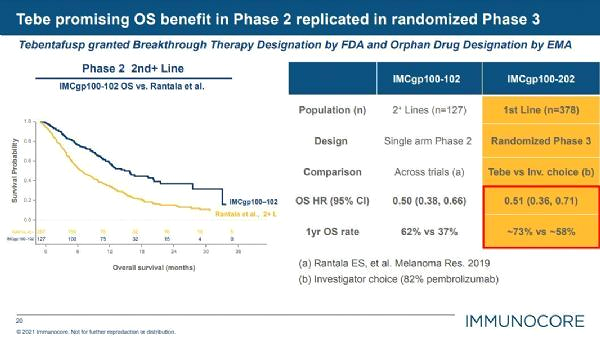
3 상 임상 시험 에서 Kimmtrak 치료는 통계적으로 유의하고 임상적으로 의미 있는 전체 생존(OS) 이점을 입증했습니다
연구자가 위약군 및 다른치료와 비교하여 사망 위험(HR=0.51)이 49% 감소했으며 OS 중앙값은 거의 22개월였습니다.
Kimmtrak의 활성 성분은 항-CD3 면역 효과기 도메인에 융합된 가용성 TCR로 구성된 새로운 이중특이성 단백질인 테벤타푸스(tebentafusp)입니다. tebentafusp는 멜라닌 세포와 흑색종 에서 발현되는 계통 항원인 gp100을 특이적으로 표적화하도록 설계되었습니다 . Tebentafusp는 Immucore의 ImmTAC 기술 플랫폼을 사용하여 개발된 최초의 분자이며 T 세포를 리디렉션하고 활성화하여 종양 세포를 인식하고 죽이도록 설계되었습니다 .
tebentafus는 이전 에 전이성 포도막 흑색종 (mUM) 치료제로 미국 FDA 로부터
BTD(Breakthrough Drug Designation),
FTD(Fast Track Designation),
ODD(Orphan Drug Designation)를 받았고 조기 치료 의약품으로 지정됐습니다.
EAMS(영국)는 획기적인 혁신의학(PIM)을 승인받았습니다.
포도막 흑색종
미국 FDA 는 무작위 3상 IMCgp100-202 임상 시험 (NCT03070392) 의 강력한 효능 데이터를
기반으로 Kimmtrak을 승인했습니다. 이 시험은 이전에 치료를 받지 않은(치료 경험이 없는)
mUM 환자를 대상으로 tebentafusp 단독요법의 효능과 안전성을 평가했습니다.
총 378명의 환자가 tebentafusp(연구군) 또는 연구자가 선택한 치료 옵션(대조군)에 2:1 비율로 무작위 배정되었습니다. 이번 연구에서 연구자들이 선택한 치료 옵션은 다카바진, 항CTLA-4 치료제 여보이(이필리무맙, 이필리무맙), 항PD-1 치료제 키트루다(Kreida, 일반명: 펨브롤리주맙, 파클리탁셀) 볼리주맙) 입니다.
최종 분석에서 이 연구는 임상 및 통계적으로 유의한 생존 이점이 입증되었습니다
임상 및 통계적으로 유의미한 1년 전체 생존율은 tebentafusp투여군에서 73.2%, 연구자가 선택한 요법에서 58.5%였다. 또한 tebentafusp 치료는 연구자가 선택한 요법에 비해 질병 진행 또는 사망(PFS) 위험을 27%(HR=0.73) 감소시켰습다. 이 연구에서 치료 관련 유해 사례는 관리 가능했고 제안된 작용 기전과 일치했습니다.
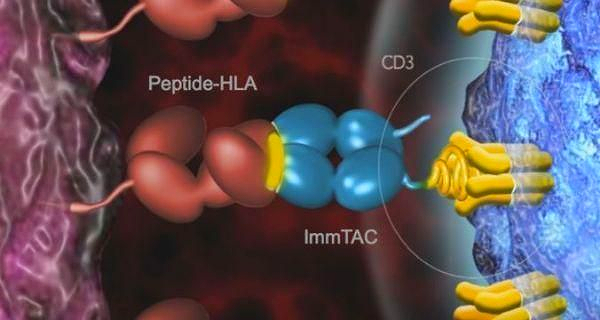
Immunocore의 핵심 기술은 조작된 T 세포 수용체(TCR)와 항-CD3 scFv로 구성된 새로운 이중특이성 생체 고분자인 ImmTAC(항종양 면역 효능제 단일클론 T 세포 수용체)입니다.
변형된 TCR은 종양 세포 표면의 항원 펩타이드-인간 백혈구 항원 복합체(pHLA)는 친화도가 현저히 개선되었으며(항원-항체의 친화도보다 9배 높음), 항-CD30 scFv 주변의 T 세포를 끌어 모으고 동원할 수 있습니다.
종양 세포를 활성화하고 T 세포를 활성화하여 종양 을 죽이는 역할을 합니다.
ImmTAC은 TCR 시스템과 항-CD3 이펙터 기능 을 결합하여 암세포에 대한 고도로 특이적인 T 세포 반응을 활성화함으로써 다른 면역 항암제 의 한계를 극복하도록 설계되었습니다. Immunocore는 ImmTAC 기술을 통해 Roche, GlaxoSmithKline , Eli Lilly 및 AstraZeneca 를 비롯한 여러 제약 대기업과 광범위한 면역 종양학 협력 에 도달했습니다.
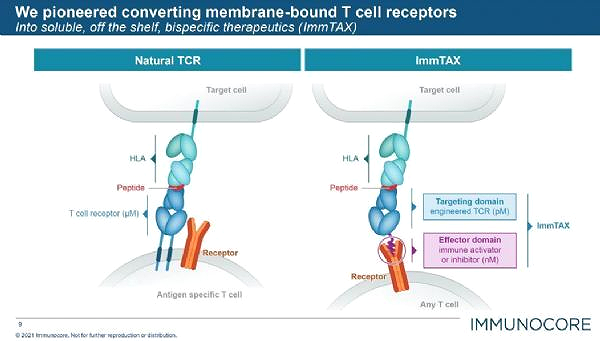
tebentafusp는 흑색종 관련 항원 gp100을 특이적으로 표적화하고 T 세포가 암세포에 대해 직접 강력하고
특이적인 반응을 할 수 있게 하도록 설계된 임상적으로 가장 빠르게 발전하는 ImmTAC 중 하나입니다 .
포도막 흑색종(mUM)은 눈의 포도막 영역에 있는 멜라닌 세포에서 발생 하는 공격적인 흑색종 입니다. mUM의 생존율은 1970년대 이후로 크게 변하지 않고 유지되었으며, 전이성 mUM이 가장 큰 질병 부담을 가지고 있습니다. tebentafusp의 승인 이전에는 전이성 UM에 대한 입증된 치료 표준이 없었지만 이 치료법을 통해 더 많은 고형암에 적용 할수 있음을 확인했습니다.
출처 문헌입니다
Immunocore announces FDA approval of KIMMTRAK® (tebentafusp-tebn) for the treatment of unresectable or metastatic uveal melanoma
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.










