2022년 다중 항원 표적 VIPER CAR 시스템
페이지 정보
작성자 PnH 조회111회 작성일 24-05-17 14:30본문
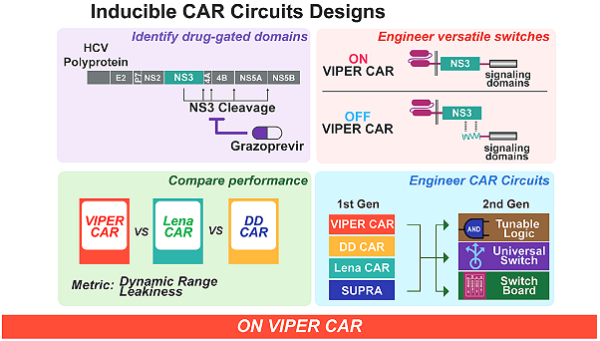
다중 항원 표적 CAR 시스템
키메라 항원 수용체 T( CAR-T ) 세포는 새로운 치료법으로 "살아있는 약"으로 불리며 항종양 치료에 혁명을 일으켰습니다.
기존 항암 약물과 달리 CAR-T 세포는 주입 후 더 다양한 효과를 갖지만 "약물"로서 직접 정량화 및 제어하기 어렵습니다.
기존 연구는 주로 CAR-T 세포의 살상 능력을 향상시키고 치료 효과를 높이는 방법에 초점을 맞추었으며 연구가 심화되고 임상 적용이 점진적으로 발전함에 따라 CAR-T 세포 요법의 부작용이 관심을 받고 있습니다. 사이토카인 방출 증후군(CRS), 항원 이탈, T 세포 고갈 등과 같은 현재의 이러한 부작용을 처리하는 방법은 주로 전신 면역억제 , 염증성 사이토카인의 항체 차단 또는 주입된 CAR-T 세포 제거를 통한 것입니다.
이러한 전략은 부작용을 어느 정도 줄일 수 있지만 효능에 일정한 영향을 미치고 환자의 종양 재발을 유발할 수도 있습니다. 그리고 다시 CAR-T 치료를 하고 싶다면 세포 확보의 어려움 또는, 치료의 위험, 높은 비용이 문제입니다. 생체 내에서 CAR-T 세포의 활성을 정량화하고 임상 적용의 추가 개발을 지원합니다.
2012년부터 2022년까지 많은 논문에서 저분자나 단백질을 통해 CAR-T 세포의 활성을 조절하는 방법을 보고했습니다. 일부 연구에서는 단일 사슬 항체(ScFv)를 CAR-T 세포(세포외 ScFv)와 종양 세포 사이의 "중개자"로 사용하여 제어 가능한 T 세포 활성화 및 다양한 항원 표적의 활성을 유도 합니다[1]. 일부 연구에서는 라파마이신 유사체를 조절제로 사용합니다[2].
다양한 방법들이 저마다의 장점과 단점이 있지만, 기존의 일부 방법에서 사용되는 저분자나 단백질은 조직침투성이 좋지 않고 임상적 사용이 승인되지 않은 등의 한계점도 존재했습니다.
최근 Boston University의 Wilson W. Wong이 이끄는 연구팀은 경구용 항간염 바이러스 약물에 의해 조절되는 일련의 다기능 프로테아제 조절 CAR(VIPER CAR) 시스템을 제안했습니다[3].
이 시스템은 미국 식품의약국 ( FDA )의 승인을 받은 약물을 사용하여 CAR-T 세포의 활성을 용량 의존적으로 조절함으로써 CAR-T 세포의 안전성을 크게 향상합니다. 이 시스템을 기반으로 Wong 팀은 CAR-T 세포의 적용 범위를 넓히기 위해 다중 표적 VIPER CAR를 설계했습니다. 관련 기사가 유명한 Cancer Cell 저널에 실렸습니다.
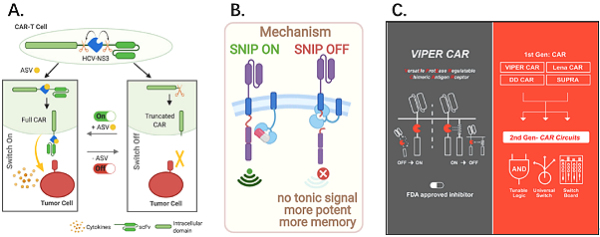
구체적으로 C형간염 바이러스 NS3(non-structural protein 3) 프로테아제를 CAR-T 세포에 도입하고, NS3 프로테아제의 활성을 억제하는 약물을 사용해 CAR-T 세포의 활성을 구현하는 (VIPER CAR) 시스템을 설계했습니다.
VIPER CAR 시스템의 작동 메커니즘
사실 NS3와 CAR-T 세포의 조합이 제안된 것은 이번이 처음이 아닙니다 Zhou Jianfeng, Wenshe Ray Liu[4] 팀, Jennifer R. Cochran 및 Crystal L. Mackall[5] 팀[5] ] Angewandte Chemie 및 Cell에 각각 게재 다른 디자인의 NS3 프로테아제 제어 하는 CAR 시스템을 발표 했습니다.
이전 보고서와 달리 Wong 팀은 기본 "ON" 또는 "OFF" VIPER CAR 시스템의 기능 및 약물 제어 가능성을 설계하고 검증했으며 CRS 동물 모델에서 CRS의 기존 CAR-T 치료에 대한 시스템의 부작용을 검증했습니다.
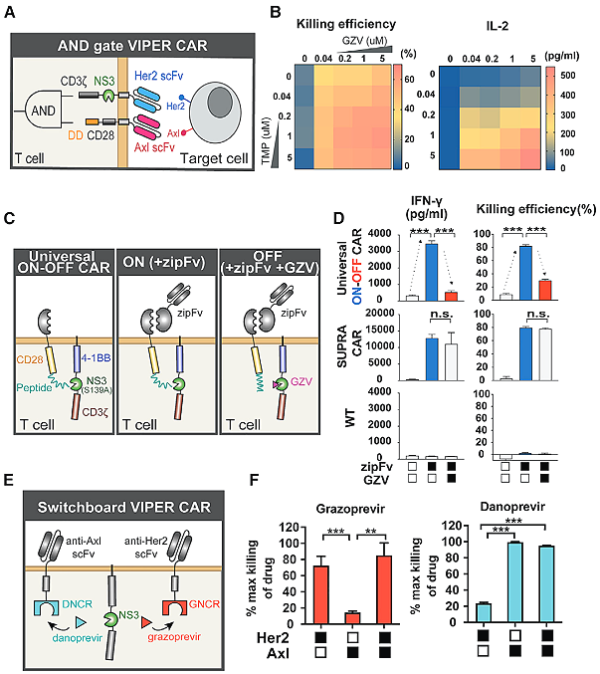
또한 복잡하고 변하기 쉬운 종양 세포를 다루기 위해 다중 제어 기능을 갖춘 보다 복잡한 2세대 VIPER CAR 시스템을 제안했습니다.
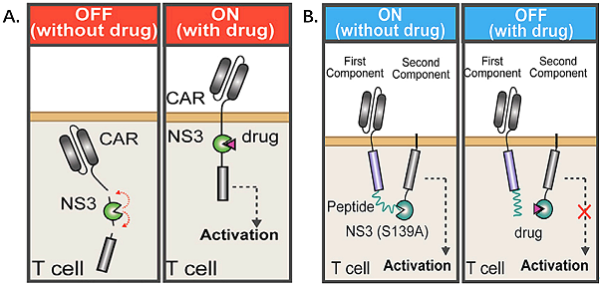
아래 그림은 "ON" 및 "OFF" VIPER CAR의 기본 디자인을 보여줍니다. ON 시스템(A)은 단일 체인 시스템입니다. 약물이 없으면 NS3는 효소 차단 역할을 하고 CAR은 완전한 신호 전달을 형성할 수 없지만, 약물을 사용하면 NS3의 가수분해가 억제되어 완전한 CAR을 형성하여 항종양 효과(즉, 약물이 추가되면 시스템은 "ON" 상태).
OFF 시스템(B)은 2개의 개별 구성요소이며, 세포외 항원 인식 도메인 및 세포내 CD3ζ 도메인은 각각 NS3 및 NS3 결합 펩티드에 의해 연결된 2개의 개별 구성요소에 배치됩니다. 약물이 첨가되지 않은 경우 NS3는 표적 펩타이드에 결합하고 두 개의 분리된 구성 요소를 연결하여 완전한 CAR 신호 전달을 형성합니다. 약을 추가할 때 시스템은 "OFF" 상태입니다).
ON" 및 "OFF" VIPER CAR 메커니즘 다이어그램
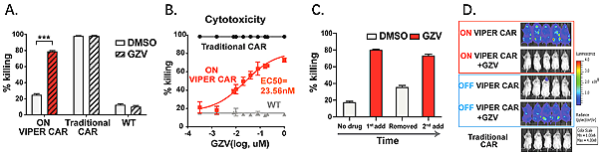
체외 실험에서 VIPER CAR-T 세포 시스템은 종양 세포를 죽이는 능력이 있으며, 그 살상 효과는 약물 용량과 관련이 있는 것으로 나타났습니다.
또한 약물을 제거한 후 약물을 다시 추가하면 여전히 기능을 복원할 수 있으므로 약물에 의해 제어되는 가역적인 VIPER CAR 시스템을 구축할 수 있습니다(아래 그림은 "ON" 시스템을 보여주고 "OFF" 시스템은 유사한 결론을 도출합니다).
ON" VIPER CAR 시스템 약물 제어 및 기능 검증
모두가 우려하는 CAR-T의 안전성에 대해서는 기존 CAR-T 요법의 이상반응 CRS를 효과적으로 개선한 'OFF' VIPER CAR 시스템을 CRS 특이적 실험 모델로 검증했습니다. 실험 결과 "OFF" VIPER CAR 시스템에 약물을 추가한 후 CRS와 관련된 사이토카인이 덜 분비되고 실험쥐의 생존율도 크게 향상되는 것으로 나타났습니다.
또한 VIPER CAR과 기존의 임상적으로 관련된 drug-gated CAR을 직접 비교하여 VIPER CAR 시스템이 최고의 약물 조절 능력과 in vitro 사멸 능력을 가지고 있음을 확인하였습니다.
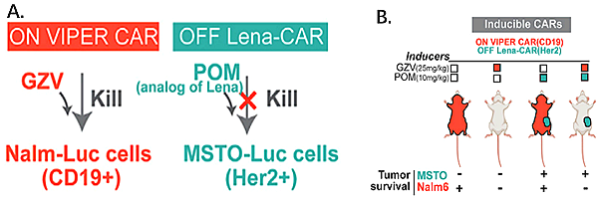
또한 VIPER CAR이 임상적으로 관련된 다른 약물 제어 CAR과 호환된다는 점을 감안하여 CD19 및 Her2를 대상으로 하는 이중 표적 직교 조절 CAR을 구축했습니다. GZV에 의해 조절되는 CD19+ 세포를 표적으로 하는 "ON" VIPER CAR과 POM에 의해 조절되는 Her2+ 세포를 표적으로 하는 "OFF" VIPER CAR을 사용하여 두 약물의 서로 다른 조합을 통해 투여 방법은 통제되고 독립적인 이중을 실현합니다.
이중 표적 약물 통제 CAR 시스템
2세대 VIPER CAR 시스템
일반적으로 Wong 팀의 연구는 FDA 승인 약물을 사용하여 CAR-T 활동을 조절하고 기존 CAR-T가 직면한 CRS와 같은 부작용을 개선하며 치료의 안전성을 향상시킵니다.
또한, 단일 VIPER CAR 시스템을 기반으로 보다 복잡한 2세대 VIPER CAR 시스템을 제안하여 VIPER CAR 시스템의 다양성을 보여주며 CAR-T 세포치료제 적용 가능성을 크게 높일수 있습니다.
승인된 두 가지 치료제의 강력한 조합으로 임상 변형 과정이 더 빨라질 것으로 믿어지며, 이 시스템이 환자에게 더 빠르고 더 나은 혜택을 줄 것으로 기대됩니다.
참고문헌입니다
[1].Labanieh L, Majzner RG, Klysz D, et al. Enhanced safety and efficacy of protease-regulated CAR-T cell receptors. Cell. 2022;185(10):1745-1763.e22. doi:10.1016/j.cell.2022.03.041
[2].Wu CY, Roybal KT, Puchner EM, Onuffer J, Lim WA. Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science. 2015;350(6258):aab4077. doi:10.1126/science.aab4077
[3].Li HS, Wong NM, Tague E, Ngo JT, Khalil AS, Wong WW. High-performance multiplex drug-gated CAR circuits [published online ahead of print, 2022 Aug 26]. Cancer Cell. 2022;S1535-6108(22)00372-5. doi:10.1016/j.ccell.2022.08.008
[4].Cao W, Geng ZZ, Wang N, et al. A Reversible Chemogenetic Switch for Chimeric Antigen Receptor T Cells. Angew Chem Int Ed Engl. 2022;61(10):e202109550. doi:10.1002/anie.202109550
[5].Labanieh L, Majzner RG, Klysz D, et al. Enhanced safety and efficacy of protease-regulated CAR-T cell receptors. Cell. 2022;185(10):1745-1763.e22. doi:10.1016/j.cell.2022.03.041
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.