2022년 12월 Cell 연구 (2)
페이지 정보
작성자 PnH 조회95회 작성일 24-05-26 14:50본문
16. Cell: 흉선 상피 세포는 아직완성되지 않은 T 세포는 신체의 다양한 조직을 시뮬레이션하여 아군과 적군을 구별하는것을 학습합니다.
인간의 면역 체계는 거의 완벽한 방어 메커니즘입니다. 그것은 질병을 일으키는 박테리아, 바이러스 및 기타 병원체로부터 신체를 보호합니다. 부상이나 감염 부위에서 세포 파편을 청소합니다. 이러한 기능을 수행하기 위해 면역 체계는 먼저 자기세포와 비자기세포를 구별해야 합니다. 즉, 신체 조직을 보호하면서 유해한 물질을 감지하고 파괴할 수 있는 놀라운 선택 능력입니다. 면역 체계가 이러한 구분을 하지 못하면 실수로 신체를 공격하여 자가 면역 질환을 일으킬 수 있습니다. 과학자들은 한동안 이 선택 능력의 일반 원리를 알고 있었지만, 면역 세포가 아군과 적군을 구별하는 방법을 정확히 어떻게 이해하고 있는지는 잘 알려져 있지 않습니다.
이제 새로운 연구에서 미국 하버드 의과대학, 일본 게이오 대학, 와카야마 의과 대학의 연구원들은 신체의 가장 강력한 면역군인 T 세포가 어떻게 자기세포와 비자기세포를 구별하는것에 집중했습니다. 새로운 연구는 주로 실험쥐에서 수행되었습니다. 관련 연구 결과는 2022년 6월 16일자 Cell 저널에 온라인 게재되었습니다. 논문 제목은 "Thymic epithelial cells co-opt lineage-defining transcription factor to remove autoreactive T cells"입니다.
새로운 연구는 면역 세포의 일종인 T 세포를 생성하고 훈련시키는 기관인 흉선이 몸 전체의 다양한 조직을 모방하여 흉선 상피 세포가 만든 단백질에 노출시켜 신생아 면역 세포를 교육한다는 것을 보여줍니다. 구체적으로, 이 연구는 서로 다른 정체성을 취함으로써 이러한 특화된 흉선 상피 세포가 성숙한 T 세포가 일단 흉선을 떠날 때 만나게 될 자가 단백질을 위해 리허설한다는 것을 보여줍니다.
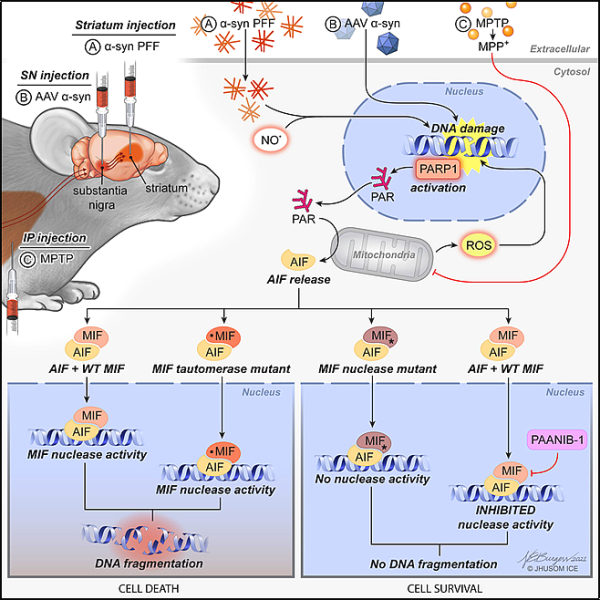
17. Cell: PAAN 뉴클레아제의 억제가 파킨슨병에서 신경퇴화를 예방할 수 있음을 발표했습니다
실험쥐를 대상으로 한 새로운 연구에서 Johns Hopkins University Medicine의 연구원들은 파킨슨병의 뇌 세포 사멸과 관련된 경로의 최종 사건을 차단하는 화합물을 확인했습니다. 그들은 그 결과가 인간의 동일한 경로를 안전하게 단절시키고 파킨슨병, 뇌졸중 및 기타 신경퇴행성 질환의 특징인 파괴적인 영향을 예방할 수 있는 약물 개발로 이어질 수 있다고 말했습니다. 관련 연구 결과는 2022년 5월 26일자 Cell에 게재되었습니다. 논문 제목은 "PAAN/MIF nuclease inhibitors prevent neurodegeneration in Parkinson's disease"입니다.
파킨슨병은 도파민이라는 신경 전달 물질을 생산하는 뇌 세포에 알파 시누클레인이 축적되는 것이 특징입니다. 잘못 단백질이 더 많이 뭉치면 Dawson과 다른 Johns Hopkins 연구원이 소위 "프로그램된" 세포 사멸 과정을 통해 뇌 세포를 죽입니다. PARP-1 의존성 세포 사멸(parthanatos)로 알려진 이 과정은 운동, 감정 조절 및 사고의 손상을 초래할 수 있습니다.
Dawson이 주도한 이전 연구에서는 PAAN(parthanatos associated apoptosis-inducing factor nuclease)이라는 단백질이 알파-시누클레인 응집체에 의해 영향을 받는 뇌 세포에 최종 타격을 가하여 세포의 DNA를 손상시키는 것으로 나타났습니다. 파킨슨병 외에도 PAAN 단백질은 뇌졸중의 세포 사멸과도 관련이 있습니다. 그러나 PAAN은 뇌를 건강하게 유지하기 위해 유지해야 하는 면역 체계의 활동을 포함하여 뇌에 여러 기능을 가지고 있습니다.
PAAN의 분자 구조에 대한 지식을 사용하여 저자는 Johns Hopkins Drug Library에서 PAAN이 DNA 분자를 분해하는 것을 특별히 방지하는 수천 가지의 알려진 화학 물질을 선별했습니다. 그들은 이러한 화학 물질이 있는 상태에서 일련의 DNA 가닥을 PAAN에 노출시킴으로써 이를 수행했습니다. 화학 물질을 첨가했을 때 DNA가 온전한 상태로 남아 있으면 PAAN이 DNA를 손상시키는 것을 방지할 수 있을 것이라고 생각했습니다. 이 테스트 동안 그들은 다른 중요한 PAAN의 활동에 영향을 미치지 않고 PAAN을 차단하는 화학 물질을 식별하고 PAANIB-1(PAAN 억제제 1, PAAN 억제제 1)이라고 명명했습니다.
18. Cell: 보다 컴팩트한 RNA 표적 유전자 편집 도구인 Cas7-11S 발견 이를 기반으로 새로운 RNA 유전자 치료제 개발 기대 합니다
지난해 매사추세츠 공과대학(Massachusetts Institute of Technology)의 뇌 연구를 위한 맥거번 연구소(McGovern Institute for Brain Research) 연구원들은 세포에 해를 끼치지 않고 절단을 지시하는 CRISPR 효소인 CRISPR 효소 유형 III-E를 발견하고 특성화했습니다. 그 과정에서 (Nature, 2021, doi:10.1038/s41586-021-03886-5). 이제 새로운 연구에서 도쿄 대학의 협력자들과 협력하여 Cas7-11이 더 작은 버전으로 축소되어 살아있는 세포 내에서 RNA를 편집하는 데 더 실행 가능한 옵션이 될 수 있음을 발견했습니다. 그들은 이 새롭고 컴팩트한 Cas7-11을 설명하는 동시에 원래 Cas7-11의 상세한 구조 분석도 수행합니다.
관련 연구 결과는 2022년 5월 27일 학술지 Cell에 "Structure and engineering of the type III-E CRISPR-Cas7-11 effector complex"라는 논문 제목으로 온라인 게재되었습니다. 논문의 교신저자는 McGovern Institute for Brain Research의 연구원인 Omar Abudayyeh, McGovern Institute for Brain Research의 연구원인 Jonathan Gootenberg, 도쿄 대학의 연구원인 Hiroshi Nishimasu입니다. 이 논문의 첫 번째 저자는 McGovern Institute for Brain Research의 전 박사후 연구원인 Nathan Zhou와 도쿄 대학의 Kazuki Kato입니다.
Abudayyeh는 "우리가 구조를 보았을 때 필요하지 않은 부분이 있다는 것이 분명해졌고 우리는 실제로 그러한 부분을 제거할 수 있었습니다. 이것은 효소를 단일 바이러스 벡터에 압축될 수 있을 만큼 충분히 작게 만들었습니다."라고 말했습니다.
저자는 Cas7-11의 새로운 3차원 구조를 효소에 대한 근본적인 생물학적 질문에 답하고 미래에 그 기능을 조정할 수 있는 추가 방법을 밝히는 풍부한 자원으로 보고 있습니다.
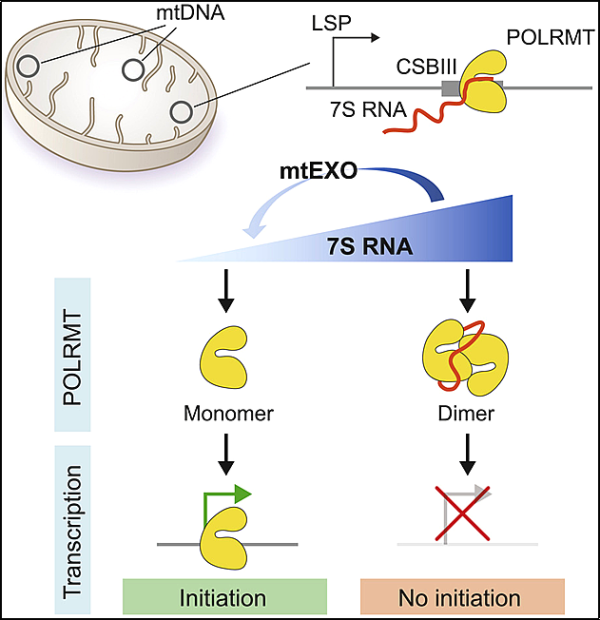
19. Cell: 인간의 미토콘드리아에서 유전자 발현을 조절하는 비암호화 7S RNA 기전 규명 했습니다.
새로운 연구에서 스웨덴 예테보리 대학, 카롤린스카 연구소, 독일 쾰른 대학의 연구원들은 비코딩 RNA 분자가 인간 세포에서 미토콘드리아 유전자 발현을 조절한다는 사실을 발견했습니다. 관련 연구 결과는 2022년 6월 2일 Cell 저널 온라인 게재되었습니다. 논문 제목은 "Non-coding 7S RNA inhibitors transcription via mitochondrial RNA polymerase dimerization"입니다. 이 논문의 교신 저자는 예테보리 대학교의 Maria Falkenberg 교수와 Karolinska Institutet의 B. Martin Hällberg입니다. 이 논문의 첫 번째 저자는 예테보리 대학의 Xuefeng Zhu와 Xie Xie, Karolinska Institutet의 Hrishikesh Das입니다.
인간 미토콘드리아 7S RNA는 포유류의 정상적인 발달에 필요한 비암호화 RNA 분자의 더 큰 계열에 속합니다. 이전에는 미토콘드리아 7S RNA의 수준이 진핵 세포의 대사 요구에 따라 달라지는 것으로 알려져 있었지만 이러한 변화의 분자적 기초 및 기능적 의미는 알려지지 않았습니다. 새로운 연구에서 저자들은 7S RNA가 정제된 단백질에 미치는 영향과 세포의 미토콘드리아 유전자 활동을 연구하는 방법을 개발했습니다.
이 저자들은 7S RNA가 시험관 내 및 배양된 인간 세포 모두에서 미토콘드리아의 전사 수준을 제어하기 때문에 조절 기능을 가지고 있음을 발견했습니다. 극저온 전자 현미경(cryo-EM)을 사용하여 그들은 미토콘드리아 RNA 폴리머라제 POLRMT가 7S RNA와 상호작용하여 이합체화한다는 것을 발견했습니다. 생성된 POLRMT 이량체 인터페이스는 프로모터 인식 및 mtDNA 풀기에 필요한 도메인을 격리하여 mtDNA 전사 개시를 방지합니다. 그들은 비코딩 7S RNA 분자가 포유류 세포에서 미토콘드리아 전사를 조절하는 음성 피드백 루프의 일부라고 제안합니다.
20. Cell: CAR-T 세포 개발로 고형암 치료에 더 안전하고 효과적일 것으로 기대 합니다
실험쥐를 대상으로 한 새로운 연구에서 스탠포드 의과대학의 연구원들은 경구용 약물로 켜고 끌 때 환자 자신의 유전적으로 변형된 면역 세포를 사용하여 암세포를 공격하는 암 치료법을 발견했습니다. 더 효과적인. 관련 연구 결과는 2022년 5월 12일 학술지 Cell에 "Enhanced safety and efficiency of protease-regulated CAR-T cell receptors" 논문 제목으로 게재되었습니다.
CAR-T 세포 요법이라고 하는 이러한 유형의 암 치료법은 특정 유형의 혈액암에 효과적인 것으로 나타났습니다. 그러나 일부 환자는 면역 세포의 일종인 유전자 조작 T 세포에 대해 생명을 위협하는 면역 반응을 나타내기 때문에 일반적으로 CAR-T 요법은 다른 치료법을 시도한 후에만 사용됩니다. 또한 뇌암 및 골암 환자와 같은 고형 종양 환자에게는 덜 성공적이었습니다. 과학자들은 과도한 신호를 보내는 경향이 있는 CAR-T 세포가 고형 종양을 제거할 수 있기 전에 기능적 실패를 겪기 때문이라고 믿고 있습니다. 또한 혈액암과 달리 고형암에서는 정상 조직이 아닌 암세포 표면에서만 발견되는 분자 표적을 식별하기 어렵습니다.
저자들은 SNIP CAR-T라고 불리는 유전적으로 변형된 CAR-T 세포 요법을 설계했는데, 이는 미국 식품의 약국 ( FDA ) 에서 인간에게 사용하도록 이미 승인한 경구용 항간염 약물로 활성화 할 수 있습니다. 이 약물이 없으면 SNIP CAR-T 세포는 비활성화됩니다.
CAR-T 세포가 환자에게 다시 주입된 후 약물로 활성을 제어하는 능력은 유전자 조작 T 세포에 잘 반응하지 않을 수 있는 환자에게 안전 메커니즘을 제공합니다. 저자들은 이 유전적으로 변형된 CAR-T 세포가 실험용 쥐의 고형 종양을 치료하는 데 훨씬 더 효과적이라는 것을 발견했습니다. 아마도 일상적인 약물이 쥐에서 대사될 때 CAR-T 세포가 짧고 반복적인 휴식 기간을 겪기 때문일 것입니다.
스탠퍼드대 소아과 교수이자 논문 교신저자인 크리스탈 맥콜 박사는 "환자별로 조절이 가능한 '원격제어' CAR-T 세포 치료제를 구축했다. 이러한 유전자변형 CAR-T 세포는 더 안전할 뿐만 아니라 원래의 CAR-T 세포보다 더 강력하고 다재다능합니다. ."
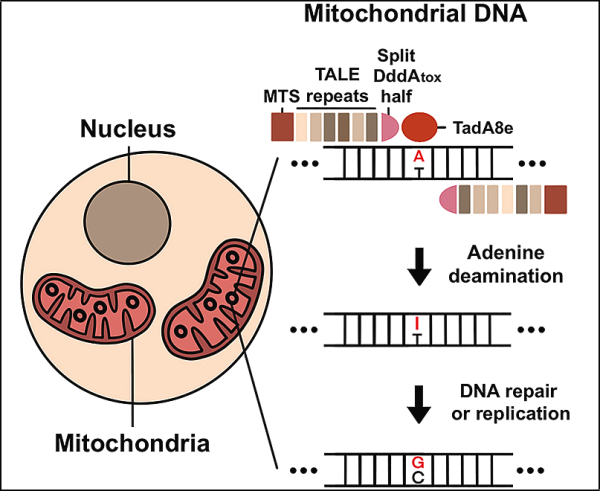
21. Cell: 새로운 미토콘드리아 염기 편집기 개발 성공 미토콘드리아 게놈 편집의 새로운 시대가 열리다
새로운 연구에서 한국 기초과학연구원(IBS)의 게놈공학센터 연구원들은 전사 활성제 유사 이펙터 관련 탈수소효소(transcription activator-like effector-linked deaminase, TALED)라는 새로운 유전자 편집 플랫폼을 개발했습니다. ). TALED는 미토콘드리아에서 A→G 염기 전환이 가능한 염기 편집자입니다. 이 발견은 인간의 유전병을 치료하기 위한 수십 년간의 노력의 정점이며, TALED는 유전자 편집 기술에서 퍼즐의 마지막 조각으로 간주될 수 있습니다. 해당 연구 결과는 2022년 4월 25일 Cell 저널에 온라인 게재되었습니다. 논문 제목은 "Targeted A-to-G base editing in human mitochondrial DNA with programmable deaminases"입니다.
이 저자들은 서로 다른 세 가지 구성 요소를 융합하여 TALED를 구성했습니다. 첫 번째 구성요소는 DNA 서열을 표적으로 하는 TALE(transcription activator-like effector)입니다. 두 번째 구성 요소는 A→G 전환을 촉진하는 아데닌 데아미나제인 TadA8e입니다. 세 번째 구성 요소는 TadA8e가 DNA에 더 쉽게 접근할 수 있도록 하는 시토신 데아미나제인 DddAtox입니다.
TALED의 흥미로운 측면은 이중 가닥 DNA(dsDNA)가 있는 미토콘드리아에서 A→G 편집을 수행하는 TadA8e의 능력입니다. TadA8e는 단일 가닥 DNA(ssDNA)에만 특이적인 것으로 알려진 단백질이기 때문에 이것은 불가사의한 현상입니다. Kim은 "미토콘드리아에서 염기 편집을 위해 TadA8e를 사용하는 것을 생각한 사람은 아무도 없었습니다. 단일 가닥 DNA에만 특이적인 것으로 여겨졌기 때문입니다. 우리가 TALED를 발명하는 데 정말 도움이 된 것은 바로 이러한 고정관념을 벗어난 사고 방식이었습니다."라고 Kim은 말했습니다.
22. Cell: 모듈식 SNIPR 수용체를 발현하는 CAR-T 세포는 독성 부작용을 줄이면서 고형 종양을 효율적으로 죽일 수 있습니다.
조작된 면역 세포, 즉 유전적으로 변형된 면역 세포를 기반으로 한 치료법이 최근 암 치료에 대한 유망한 접근 방식으로 부상했습니다. 조작된 면역 세포는 기존 약물보다 암세포를 탐지하고 제거하는 능력이 더 정확하고 정교합니다. 그러나 이러한 가능성에도 불구하고 세포 기반 치료법은 독성 및 건강한 세포를 공격할 수 있는 가능성을 포함하여 여전히 중요한 한계에 직면해 있습니다. 또한 과학자들은 기존의 치료 세포를 유전적으로 수정하여 응용 분야를 확장하거나 활동을 더 잘 제어하는 방법을 잘 파악하지 못하고 있습니다.
이러한 한계를 극복하기 위해 Gladstone Institutes와 UCSF의 연구원들은 새로운 연구에서 치료 세포를 조작하는 데 사용되는 분자 구성 요소에 대한 체계적인 분석을 수행했습니다. 그들의 연구는 더 높은 특이성과 안전성을 갖춘 치료 세포를 설계하고 궁극적으로 세포 기반 요법을 맞춤화하기 위한 포괄적인 규칙을 만듭니다. 해당 연구 결과는 2022년 4월 14일 학술지 Cell에 "Modular design of synthetic receptors for programd gene regulation in cell therapies"라는 논문 제목으로 게재되었습니다.
저자들은 SNIPR(synthetic intramembrane proteolysis receptors)이라고 하는 수용체 목록을 작성했는데, 이는 인간 세포에서 저렴하게 조작할 수 있을 만큼 충분히 작습니다. 그들은 또한 전적으로 인간 수용체 조각으로 만들어지며 적은 수의 표적을 탐지하고 대응할 수 있습니다. 또한 SNIPR의 활성은 SNIPR을 운반하는 세포가 표적 세포를 죽일 뿐만 아니라 특정 분자를 정확한 질병 위치에 전달하도록 조정할 수 있습니다.
저자는 다음으로 백혈병 , 중피종 및 난소암 의 마우스 모델에서 종양을 제거하는 이러한 최적화된 수용체의 능력을 평가했습니다 . 비표적 세포를 죽일 가능성을 줄이기 위해 그들은 종양 표면의 한 분자를 인식하도록 조작된 SNIPR을 다른 종양 분자를 인식하도록 유전적으로 변형된 CAR 수용체와 결합했습니다. 또한 그들은 SNIPR 수용체 활성화에 의존하는 CAR 수용체 생산을 만들었습니다. 이러한 방식으로, synNotch 및 CAR 수용체의 표적을 운반하는 세포만 죽이는 반면, 표적 중 하나만 운반하는 세포는 죽지 않을 것입니다.
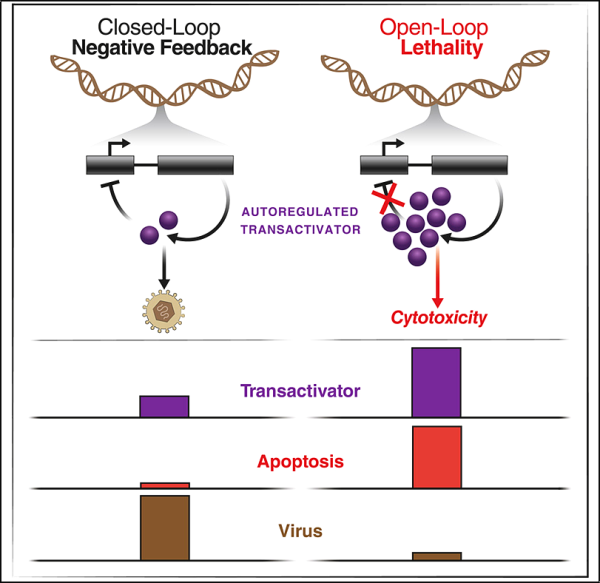
23. Cell: 바이러스 감염과 심지어 암을 치료할 수 있는 새로운 종류의 약물에 대한 가능성을 보여줍니다.
헤르페스 바이러스 계열의 바이러스는 전 세계적으로 선천적 결함, 실명 및 장기 이식 실패의 주요 원인입니다. 항바이러스 약물은 이러한 바이러스와 싸울 수 있지만 환자는 종종 이러한 약물에 대한 내성이 생겨 효과가 없게 됩니다.
이제 새로운 연구에서 Gladstone Institutes의 Leor Weinberger 박사와 Sonali Chaturvedi 박사와 그들의 연구팀은 피드백 파괴자라고 하는 새로운 종류의 약물을 개발했습니다. 증명 약물, 즉 내성 방지 약물). 관련 연구 결과는 2022년 5월 12일 Cell 저널에 온라인으로 게재되었습니다. 논문 제목은 "Disrupting autorepression circuitry generate 'open-loop lethality' to yield 탈출 저항성 항바이러스제"입니다.
바이러스 성장에 중요한 일부 바이러스 단백질은 고농도에서 숙주 세포에 독성을 나타낼 수 있습니다.
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.