2023년 TCR-T CAR-T TILs 연구 보고서 (2)
페이지 정보
작성자 PnH 조회99회 작성일 24-05-26 14:34본문
6. Front Immunol: 과학자들은 CAR-T 세포 치료에 대한 암 환자의 반응을 조기에 예측할 수 있는 새로운 바이오마커를 발견했습니다.
B 세포 특이적 분화 항원 CD19의 프로항원 수용체 T(CART)를 표적으로 하는 것은 재발성/불응성 미만성 거대 B 세포 림프종(DLBCL)의 하위 집합에서 임상적 효능을 보여주었습니다. CAR-T 세포 치료 반응을 예측하는 바이오마커로는 충분하지 않습니다. 비엔나 의과 대학 및 기타 기관에서 CAR-T 세포 치료에 대한 높은 수준의 임상 반응을 발견했습니다. 잠재적인 바이오마커는 림프종에 대한 이 새로운 치료법의 최적 사용을 위한 전제 조건을 설명하는 동시에 현재 발견은 최적화를 향한 중요한 단계를 나타냅니다.
미만성거대B세포림프종(DLBCL, 미만거대B세포림프종)은 가장 흔한 림프종(비호지킨 림프종)으로 해당 환자의 5년 생존율은 55~64%로, 질병이 조기에 재발한 환자 또는 조합 항체 화학 요법에 반응하지 않은 경우 예후가 더 나쁠 수 있습니다. 최근 몇 년 동안 CAR-T 세포로 알려진 영향을 받은 환자를 위한 매우 효과적인 형태의 치료법이 등장했는데, 이 세포는 신체 자체의 림프구를 꺼내어 림프종을 특이적으로 표적으로 하는 세포로 무장합니다. 키메라 T 세포 수용체가 있는 세포( CAR) 그런 다음 세포를 증식시켜 환자에게 다시 재주입하고 CAR의 발현 덕분에 T 세포가 킬러 세포로 전환되고 최선의 경우 림프종 세포도 영구적으로 제거할 수 있습니다. 이 치료법은 CAR-T 세포가 림프종 세포에 반응할 때 매우 효과적일 수 있고 장기 생존을 달성할 수 있지만 불행히도 모든 환자에게 효과가 있는 것은 아닙니다.
이번 임상 연구에서 과학자들은 CAR-T 세포 생성의 기원, 즉 환자 자신의 T 림프구의 특성에서 출발하여 그 과정에서 림프종 환자는 일반적으로 T 림프구의 손실(T 림프구 감소증)을 보인다는 사실을 발견했습니다. , 림프구의 감소는 일반적으로 소진된 T 세포의 증가를 동반하기 때문에 연구자들은 이러한 세포의 수를 측정하기 시작했으며 실제로 연구자들은 일부 환자에서 소진된 T 세포의 수가 크게 증가할 것이라는 것을 발견했습니다. 이와 같은 세포는 일반적으로 만성 염증을 앓고 있는 환자에게만 존재합니다.
이러한 관찰을 바탕으로 연구자들은 환자 집단을 CAR-T 세포 요법에 대한 반응 확률이 높은 환자군과 반응 확률이 낮은 환자군으로 나누었습니다. 윈프리드 피클(Winfried Pickl) 연구원은 이번 연구 결과는 T 세포의 성질이 CAR-T 세포의 생성에 매우 중요하다는 것을 보여주고 있으며 소진된 T 세포도 상당한 비율의 환자에서 발견될 것이며 이는 이후 CAR 구성에 결정적이라고 말했습니다. 연구진은 CAR-T 세포 생산을 위한 출발 물질로 사용된 서로 다른 소진된 T 세포의 작용을 관찰하고 분화 정도가 CAR-T에 의한 암세포의 직접적인 사멸에 부정적인 영향을 미치지는 않지만 백혈병 세포에는 영향을 미치지 않는다는 것을 발견했습니다. CAR-T 세포의 세포 의존적 성장 및 인자 생성은 특정 부정적인 영향을 미칠 수 있습니다. 관련 연구 결과 소진된 CD27-CD28-CAR-T 세포는 환자에서 오랫동안 지속되지 않을 수 있으며, 이는 장기 효능을 제한할 수 있습니다. .
7. Nat Med: 새로운 T 세포 요법은 초기 항종양 활성을 나타낼 수 있습니다.
친화력이 최적화된 T 세포 수용체는 입양 T 세포 요법의 효능을 향상시킬 수 있습니다. "라고 텍사스 대학교 MD 앤더슨 암 센터 및 기타 기관의 과학자들은 연구를 통해 1상 임상 시험에서 Afamitresgene autoleucel(afami-cel; 이전에 MAGE -ADP-A2M4의 A4 암 항원)은 다양한 고형암 환자에서 놀라운 치료 결과를 달성했습니다.
이러한 유형의 요법의 효능은 모든 암 유형에 대한 전체 반응률 24%와 비교하여 요법이 44%의 객관적 반응률을 달성한 활막 종양 환자의 하위 그룹에서 특히 주목할 만했습니다. ; 이 임상 시험의 예비 데이터는 2020년 미국임상종양학회( ASCO ) 연례 회의에서 발표되었으며 , 초기 연구 결과는 고형 종양에서 새로운 세포 요법의 개념 증명 결과를 보여줍니다. 활막 종양 환자는 고용량 ifosfamide, afami-cel 요법을 사용한 화학 요법 후 실제 치료 옵션이 매우 제한적이기 때문에 환자의 높은 반응률이 중요하다. 다른 유형의 암에서의 초기 활성의 관련 연구 결과는 이것이 현재 치료되고 있는 고형 종양에서 역할을 할 수 있는 접근법일 수 있음을 시사합니다.
새로운 T 세포 요법은 초기 항종양 활성을 나타낼 수 있습니다. 이미지 제공: Nature Medicine (2023) DOI: 10.1038/s41591-022-02128-z.
TCR 요법의 목적은 일반적으로 키메라 항원 수용체(CAR) 기반 세포 요법과 관련된 정상 세포에 대한 독성 영향 없이 고형 종양 세포를 보다 정확하게 표적화하는 것입니다. 특정 세포 표면 단백질을 인식할 수 있습니다. 세포에 존재하는 특정 단백질을 표적으로 할 수 있고, TCR 요법은 특정 단백질 조각(예: MAGE-A4의 조각)이 세포 표면의 면역 관련 단백질에 결합하는 것을 인식할 수 있습니다. 본 연구에서 총 38명의 환자가 아파미셀 치료를 받았고, 평균 3개의 이전 치료를 받았고, 참가자의 58%는 남성, 92%는 백인, 나머지는 아시아인이었습니다. 활막 종양 환자 16명, 난소암 환자 9 명, 두경부암 환자 3명, 동시에 식도암, 비세포 폐암, 요도 암, 점액양/원세포 지방육종 환자 각각 2명이 포함되었으며,위암 환자 1명과 흑색종 환자 1명.
모든 환자는 치료 관련 이상반응을 경험했으며, 그 중 저혈구수(림프구감소증, 백혈구감소증, 호중구감소증, 빈혈 및 혈소판감소증)가 가장 흔했습니다. 17명의 환자(45%)는 아파미셀 치료 4주 후에 장기간 혈구감소증을 경험했고, 2명의 환자는 시험 관련 사망을 경험했는데, 이는 선별 시 최대 연령을 낮추고 고용량 사이클로포스파미드 림프구 고갈 전략을 중단했을 것입니다. 반응 시간 중앙값은 모든 환자에서 26주, 활막종 환자의 하위 그룹에서 28주였습니다. 활막 종양 환자의 발견은 과학자들이 진행된 활막 종양 또는 점액양/원형 세포 지방육종 환자에서 2상 아패미셀 시험을 수행하도록 자극했습니다.
8. 세포: CAR-T 세포는 혈액암을 치료하는 것 외에도 자가면역질환을 치료할 것으로 기대됩니다.
CAR-T 세포(즉, CAR을 발현하도록 유전적으로 변형된 면역 세포)로 알려진 조작된 면역 세포는 개인화된 면역 요법이 혈액암과의 싸움에서 무엇을 할 수 있는지를 세상에 보여주었습니다. 이제 과학자들은 루푸스라고 불리는 자가면역 질환을 앓고 있는 소규모 환자 그룹에서 CAR-T 세포 요법의 매우 유망한 초기 결과를 보고했습니다. 펜실베니아 대학교 Perelman School of Medicine의 CAR-T 세포 치료 선구자인 Carl June 박사와 University of Pennsylvania Perelman School of Medicine의 세포 및 분자 생물학 박사 과정 학생인 Daniel Baker는 다음과 같은 논문을 발표했습니다.
2022년 11월 23일자 Cell 저널에 실린 보고서. "CAR T 요법이 자가면역 질환에 치료 범위를 확장합니다"라는 제목의 발전에 대해 논의합니다.
CAR-T 세포 치료제는 각 환자 자신의 면역 세포를 사용하여 구성됩니다 -- T 세포는 환자의 혈액에서 채취되어 특정 표적 세포를 인식하도록 실험실에서 유전 공학적으로 조작되고 배양 하게 됩니다. 세포는 챔버에서 증식한 다음 재주입됩니다. 두 번째 CAR-T 세포 치료제인 Kymriah는 June과 펜실베이니아 대학교 Perelman School of Medicine의 그의 팀에 의해 개발되었으며 2017년에 FDA 승인을 받았습니다 . 현재 미국에는 6개의 서로 다른 암을 치료하기 위해 6개의 FDA 승인 CAR-T 세포 치료법이 있습니다. 이러한 치료법은 특정 B세포 백혈병, 림프종 및 기타 혈액암의 치료에 혁명을 일으켜 희망이 거의 없었던 많은 환자들에게 장기적인 완화를 가져왔습니다.
CAR-T 세포 연구 초기부터 전문가들은 T 세포가 B 세포 암 외에도 많은 질병과 싸우기 위해 유전적으로 변형될 수 있다고 믿었습니다. Penn's Perelman School of Medicine과 생명공학 회사의 팀을 포함하여 전 세계 수십 개의 연구팀이 Penn에서 개발한 개인화된 세포 치료 구조에서 효과적인 치료법을 개발하기 위해 노력하고 있으며 이러한 새로운 응용 가능성을 연구하고 있습니다.
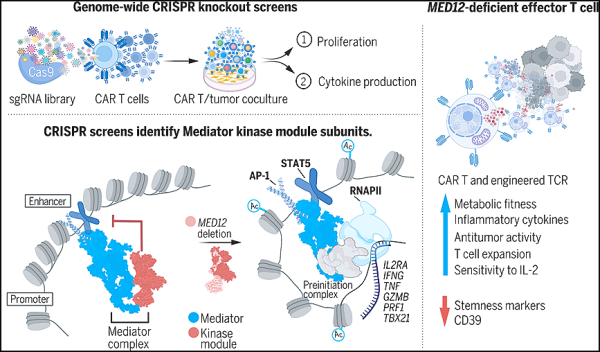
9. 과학: 중재자 복합 키나아제 모듈을 표적으로 하면 CAR-T 세포의 항종양 효능을 향상시킬 수 있습니다.
T 세포 면역 요법은 일부 암에 대해 인상적인 효능을 보여주었지만 대부분의 환자는 지속적인 반응을 얻지 못했습니다. 이러한 종류의 면역 요법의 진행에 대한 중심 장애물은 T 세포 고갈, 세포노화, 무반응 및 면역 억제를 비롯한 다양한 요인으로 인해 발생하는 막대한 종양 부담을 근절하기 위한 T 세포의 비효율성입니다. 유전자 편집은 암 면역 요법의 효능을 향상시킬 수 있는 잠재력을 가지고 있지만 T 세포의 효능을 증가시키기 위해 편집될 때 어떤 유전자 또는 유전자 그룹이 가장 효과적인지는 불확실합니다.
새로운 연구에서 스탠포드 대학의 연구원들은 인간 T 세포에서 게놈 차원의 CRISPR 유전자 녹아웃 스크린을 사용하여 T 세포 생존 능력의 조절자를 식별했습니다. 관련 연구 결과는 2022년 11월 11일 사이언스지에 "Enhanced T cell effector activity by targeting the Mediator kinase module" 논문 제목으로 게재됐다.
중재자 복합 키나아제 모듈의 파괴는 인간 T 세포에서 이펙터 프로그래밍을 전사적으로 재배선합니다 Science, 2022의 이미지, doi:10.1126/science.abn5647
이 저자들은 만성 항원 노출을 시뮬레이션하여 T 세포 기능 장애를 유도하는 모델 시스템을 사용하여 인간 키메라 항원 수용체(CAR) T 세포(CAR-T)에서 두 개의 CRISPR 스크린을 수행했습니다. 높은 증식률과 사이토카인 생산이 가장 강력한 항종양 T 세포의 특징이라는 가설을 바탕으로 그들은 증식하여 인터루킨-2(IL-2)와 종양 괴사 인자-알파(TNFα)가 풍부한 가이드를 생성하는 세포를 식별했습니다.
두 CRISPR 스크린 모두 Mediator complex 키나아제 모듈에 포함된 Mediator complex의 서브유닛을 인코딩하는 유전자를 확인했습니다. 중재자 복합체는 인핸서 결합 전사 인자와 일반 전사 기계 사이의 다리 역할을 하며 전사 네트워크를 조정하여 세포 정체성을 확립하는 데 중심적인 역할을 합니다. 인간 CAR-T 세포에서 MED12(매개자 복합체 소단위 12) 또는 CCNC(사이클린 C)의 표적 고갈은 증가된 증식, 사이토카인 생산 및 종양 제거를 초래했습니다. 여러 종양 항원을 표적으로 하는 CAR과 CD28 또는 4-1BB를 사용한 동시 자극, 그리고 조작된 T 세포 수용체(TCR)를 발현하는 T 세포에서도 유사한 효과가 관찰되었습니다. 많은 모델 시스템에서, 줄기 표현형과 전사체 서명을 가진 T 세포는 더 높은 항종양 효능을 보였지만, MED12-결손된 T 세포는 약화된 줄기와 강화된 효과기 세포 표현형 및 전사체 특징을 보였습니다. 이펙터 세포 표현형과 일치하게 MED12가 고갈된 T 세포는 향상된 대사 활동과 역가를 나타냈으며 해당 작용, 산화적 인산화 및 여분의 호흡 능력이 특징입니다. MED12 결핍 T 세포는 장기 배양 및 시험관 내 및 생체 내 종양에 대한 반복 노출 후에도 지속적인 효능을 나타냅니다. 중간 복합 키나아제 모듈의 촉매 서브유닛인 사이클린 의존성 키나아제 8 및 19(CDK8/19)의 소분자 매개 억제는 또한 건강한 비조작 T 세포의 증식을 증가시켰습니다.
이러한 관찰을 이해하기 위한 기초를 제공하기 위해 이 저자들은 MED12가 고갈된 T 세포에서 염색질 접근성 및 변형의 변화를 평가했습니다.
염색질 면역침전 시퀀싱을 이용하여 야생형 CAR-T 세포에서 Mediator complex kinase module과 Mediator complex core module(core Mediator)이 기본적으로 co-localized 되지만, MED12의 소실로 인해 Mediator complex의 염색질 점유율이 증가함을 확인하였습니다. 이것은 Median complex core module과 RNA polymerase II (RNAPII) 사이의 상호 작용을 조절하는 Median complex kinase 모듈의 알려진 역할과 일치하며 T 세포에서 MED12 또는 CCNC 삭제가 선택적으로 중재자 복합 코어 모듈 및 RNAPII는 세포를 증가시키고 T 세포 기능을 조절합니다. 이와 일치하여, MED12 결핍 CAR-T 세포에서 MED1 염색질 점유율이 증가한 영역은 H3K27 아세틸화 증가를 보여 T 세포 운명에서 중요한 역할을 하는 세포 인자가 풍부해졌습니다. MED12 결핍 T 세포에서 STAT5에 대해 가장 현저한 향상이 관찰되었으며, 이는 IL-2에 대한 민감도 증가로 나타났습니다. IL-2에 대한 조작되지 않은 T 세포의 증가된 민감성은 또한 소분자 CDK8/19 억제제에 대한 노출 때문일 수 있습니다.
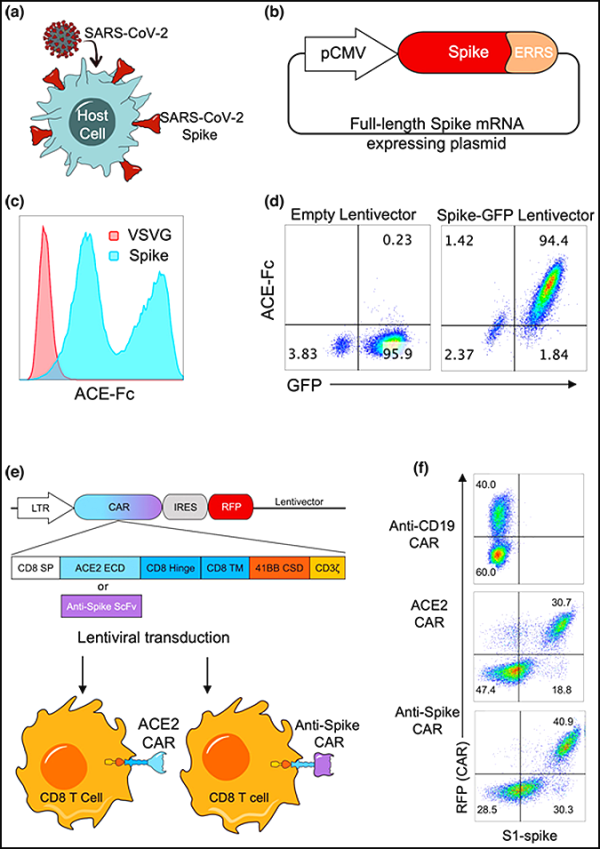
10. Clin Transl Immunol: 암 면역 요법 기술을 사용하여 SARS-CoV-2 감염 치료 가능성이 있는 면역 요법 개발
수백만 명이 SARS-CoV-2 감염으로 사망하고 수백만 명이 COVID-19(Long COVID) 및 COVID-19 치료 의 장기적인 후유증을 계속 경험함에 따라 실용적이고 접근 가능하며 강력한 SARS-CoV-2 예방 조치의 발견 중요합니다.
새로운 연구에서 미국 잭슨 유전체 의학 연구소의 Derya Unutmaz 박사와 그의 연구팀은 SARS-CoV-2 바이러스를 제거하기 위해 암 치료에 일반적으로 사용되는 CAR-T 세포 요법을 사용했습니다. 그들은 COVID-19의 치료 및 예방을 탐구하기 위한 몇 가지 면역 기반 전략을 시연합니다. 관련 연구 결과는 최근 Clinical & Translational Immunology 저널에 "ACE2를 통합한 CAR-T 유사 이중특이성 T 세포 관여자를 통한 SARS-CoV-2 감염 표적화"라는 제목으로 게재되었습니다.
Clinical & Translational Immunology의 이미지, 2022년, doi:10.1002/cti2.1421.
인간 1차 CD8 T 세포는 SARS-CoV-2 스파이크 단백질을 나타내는 숙주 세포를 표적으로 하는 CAR 분자를 발현하도록 유전자 조작되었습니다.
첫 번째 면역 요법은 SARS-CoV-2 바이러스 표면에 존재하는 스파이크 단백질과 안지오텐신 전환 효소 2(ACE2)라고 하는 숙주 세포 표면의 수용체에 초점을 맞춥니다. 이 스파이크 단백질은 건강한 숙주 세포를 감염시키는 역할을 합니다. 단백질은 ACE2 수용체를 통해 숙주 세포로 들어가 바이러스의 RNA가 이를 인계하기 시작할 수 있도록 합니다. 이 새로운 연구에서, T 세포는 다양한 감염된 세포 유형의 성별과 효율성에서 높은 특이성을 가진 스파이크 단백질 또는 ACE2 수용체를 표적으로 하는 안티 스파이크 및 안티 ACE2 CAR-T 세포가 되도록 유전적으로 조작되었습니다.
두 번째 면역 요법은 SARS-CoV-2 감염을 예방하는 항체 기반 수단을 제공합니다. T 세포는 감염 후 세포 표면에 SARS-CoV-2 스파이크 단백질을 제시하는 숙주 세포를 파괴하기 위해 환자 자신의 T 세포를 활성화하기 위해 ACE2에 융합된 이중특이성 항체를 발현하도록 유전자 조작되었습니다. 이 ACE2 이중특이성 항체 요법은 감염된 세포를 죽이도록 유전적으로 신체 외부에 세포를 두는 대신 개인 내 건강한 T 세포를 활성화하여 숙주 세포 감염 후 SARS-CoV-2 스파이크 단백질을 제시하는 세포를 표적으로 삼습니다.
COVID-19에 대한 이 CAR-T 세포 요법과 이 ACE2 이중특이성 항체 기반 요법은 모두 향후 COVID-19의 치료 및 예방을 위한 유망한 잠재적 전략을 제공합니다.
11. Blood: 소아암에서 CAR-T 세포 치료 결과는 경제적 지위에 따라 차이는없습니다.
건강의 사회적 결정 요인은 많은 질병의 결과에 영향을 미치며 소아암도 예외는 아닙니다. 실제로 가난하게 사는 급성 림프구성 백혈병(ALL) 어린이는 부유한 가정의 어린이보다 암 재발 및 사망 가능성이 더 높습니다. 새로운 연구에서 펜실베이니아 대학과 필라델피아 어린이 병원을 포함한 연구 기관의 연구원들은 사회 경제적 지위가 종종 생존 결과에 영향을 미치기는 하지만 재발성/불응성 ALL로 빈곤에 처한 어린이들이 CAR-T 세포 치료를 받은 후 전체 생존율이 사회 경제적으로 유리한 가정의 자녀만큼 가능성이 높습니다. 관련 연구 결과는 2022년 11월 9일 Blood 저널에 온라인으로 게재될 예정입니다. 논문 제목은 "Impact of poor and Neighborhood chance on results for children Treated with CD19-directed CAR T-cell therapy"입니다.
그들의 결과는 지역사회 기회가 적은 가난한 가정에 사는 환자와 더 많은 혜택을 받는 가정(빈곤에 살지 않거나 지역사회 기회가 더 높은)에 사는 환자 사이에 전체 생존율이나 완전 관해율에 유의미한 차이가 없음을 보여주었습니다.
흥미롭게도, 이 데이터는 또한 더 유리한 가정의 어린이가 CAR-T 세포 주입을 위해 의뢰되었을 때 높은 질병 부담을 가질 가능성이 훨씬 더 높다는 것을 보여주었습니다. 높은 질병 부담이 더 나쁜 결과 및 더 큰 독성 위험과 관련되어 있다는 점을 감안할 때, 중증 형태의 질병을 앓는 어린이는 일반적으로 CAR-T 세포 치료의 위험이 더 큰 것으로 간주됩니다.
"우리는 질병 부담이 높은 환자가 더 아픈 경향이 있다는 것을 알고 있지만, 이 데이터는 더 높은 질병 부담을 가진 더 유리한 가족의 사람들이 여전히 CAR-T 세포 요법에 대한 추천에서 낮은 사회 경제적 그룹의 환자는 그렇지 않을 수 있음을 시사합니다. 동일한 치료를 옹호하는 데 더 많은 어려움에 직면할 수 있습니다 질병 치료에 부담 차이가 나타나는 이유를 정확히 말할 수는 없지만 의사 추천에 의한 또는 더 큰 유연성 때문일 수 있습니다."
12. JITC: GPC2를 표적으로 하는 CAR-T 세포 개발, 소아 뇌종양 치료에 활용 기대
면역요법이 많은 혈액암의 치료에 혁명을 일으켰지만, 이 분야는 고형 종양에 대한 유사한 치료법을 개발하는 데 어려움을 겪었습니다. 소아 뇌종양은 소아암 사망의 주요 원인입니다. 소아 뇌종양에 대한 면역 요법을 개발할 때 문제에는 종양 표면에서 좋은 표적을 식별하고 원치 않는 부작용을 일으키지 않고 뇌에서 작동하는 접근 방식을 얻는 것이 포함됩니다.
이제 새로운 개념 증명 연구에서 필라델피아 어린이 병원의 연구원들은 다양한 소아 뇌종양의 표면에 존재하는 단백질을 확인했으며 전임상 모델에서 면역 요법과 함께 사용하기에 안전한 단백질을 발견했습니다. 및 이 단백질을 효과적으로 표적화하는 방법. 관련 연구 결과는 최근 Journal for ImmunoTherapy of Cancer에 "Development of GPC2-directed chimeric antigen receptors using mRNA for pediatric brain tumors"라는 제목으로 게재됐다.
Journal for ImmunoTherapy of Cancer의 이미지, 2022년, doi:10.1136/jitc-2021-004450.
GPC2는 소아 뇌종양에서 발현됩니다.
저자들은 먼저 단백질 글리피칸 2(GPC2)가 뇌종양 세포의 표면에서 발현되는지 여부를 조사했는데, 이는 이전 필라델피아 어린이 병원 및 기타 연구에서 이 단백질이 신경모세포종, 기타 소아 뇌종양 및 뇌종양에 과발현된다는 것을 보여주었기 때문입니다. 성인 뇌종양의 표면. GPC2는 면역 요법의 좋은 표적이 되는 많은 주요 특성을 가지고 있으며 필라델피아 어린이 병원 및 기타 기관에서 신경모세포종에서 GPC2를 표적으로 하는 면역 요법을 사용하는 전임상 연구 작업으로 인해 2023년에 개시될 임상 시험이 시작되었습니다.
뇌에서 GPC2를 표적으로 하는 CAR의 수준을 더 잘 제어하기 위해 저자는 COVID-19 mRNA 백신에 사용된 것과 유사한 mRNA 전달 시스템을 사용했습니다. 그들은 GPC2 표적 CAR(mRNA CAR)을 발현하는 mRNA 전사체를 정제했습니다. 그들은 수집한 T 세포를 사용하여 전기천공법(electroporation)이라는 기술을 사용하여 T 세포의 세포막을 일시적으로 열고 이 mRNA 전사물을 세포 안으로 가져왔습니다. 그런 다음 유전자 조작된 T 세포를 시험관 내 및 생체 내 뇌암 모델에서 테스트했습니다.
저자들은 그들의 mRNA CAR이 수모세포종과 고급 신경아교종을 시험관 내에서 공격하고 생체 내 전임상 모델에서 효과적이라는 것을 발견했습니다. 그들의 mRNA CAR은 약 5-7일의 짧은 기간 동안 발현되므로 임상 환경에서 전략적 용량 조절이 가능합니다.
13. Science Sub-journal: 암 치료에 가장 효과적인 CAR-T 세포를 결정하기 위한 CAR 결합 스크리닝 방법 개발
최근 몇 년 동안 종양 세포를 인식하고 파괴하는 분자 무기를 갖춘 유전자 조작 면역 세포가 암 치료의 양상을 바꿔 놓았습니다. 이제 새로운 연구에서 샌프란시스코 캘리포니아 대학의 연구원들은 각각 약간 다른 분자 특성을 가진 많은 수의 CAR-T 세포를 비교하여 어떤 CAR-T 세포가 가장 효과적이고 내구성이 있는지를 결정하는 새로운 방법을 개발했습니다. 암에 대하여. 관련 연구 결과는 2022년 11월 9일자 Science Translational Medicine 저널에 게재되었습니다. 논문 제목은 "Pooled screening of CAR T cells Identifys various immuno signaling domains for next-generation immunotherapies"입니다.
Science Translational Medicine의 이미지, 2022년, doi:10.1126/scitranslmed.abm1463.
새로운 연구에서 저자는 40개의 서로 다른 키메라 항원 수용체(CAR)로 CAR-T 세포를 연구하기 위해 CAR 풀링이라고 하는 이 방법을 개발했습니다. 향후 수백 또는 수천 개의 수용체 조합을 테스트하기 위해 확장될 수 있는 이 스크린은 새롭고 놀라운 CAR을 발견하여 이러한 치료용 CAR-T 세포를 더욱 강력하게 만듭니다.
"CAR-T 세포는 혈액암을 앓고 있는 많은 환자들에게 절대적으로 변형적입니다." 논문의 수석 저자이자 UCSF의 미생물학 및 면역학 부교수인 Kole Roybal 박사는 말했습니다. 더 많은 암 유형을 치료하는 데 사용됩니다."
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.