2023년 5세대 CAR-T 면역세포 연구
페이지 정보
작성자 PnH 조회85회 작성일 24-05-26 16:23본문
키메라 항원 수용체 T 세포 요법( CAR-T )은 혈액 악성 종양 치료에서 인상적인 성공을 거두었지만 자가 CAR-T 세포 요법의 현재 전신 독성과 복잡한 배양 공정으로 인해 더 넓은 적용을 방해합니다. 보편적으로 CAR-T 세포는 건강한 사람으로부터 동종 T 세포를 분리 및 편집하여 생산 공정을 단순화하기 위해 개발되었지만 동종 CAR-T 세포는 최근 안전성 문제에 직면하여 일부 임상 시험이 FDA 에 의해 중단되었습니다 . 따라서 현재 CAR-T 세포 치료의 장벽을 극복할 수 있는 새로운 방법을 찾는 것이 시급합니다.
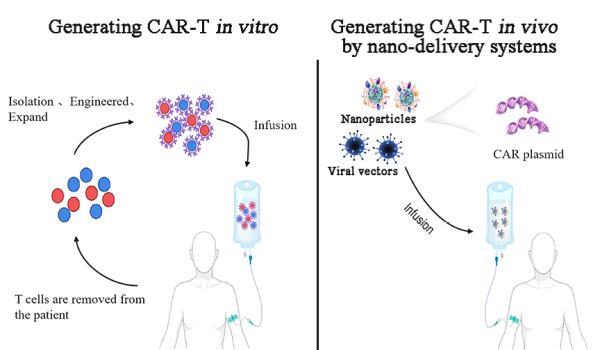
연구에서 CAR 유전자와 유전자 편집 도구가 탑재된 나노운반체에 의해 유도된 생체 내 CAR-T 세포는 백혈병을 치료 하고 전신 독성을 낮추는 효능을 보여주었습니다. 자가 T 세포의 프로그래밍은 동종이계 T 세포의 안전 문제를 피하고 제조가 표준화하기 더 쉽습니다. 따라서, 생체내 유도된 CAR-T 세포는 현재 CAR-T 세포 요법의 많은 한계를 극복할 것으로 예상됩니다.
키메라 항원 수용체 T 세포 요법(CAR-T)은 합성 수용체를 T 세포에 결합하여 표적 리간드로 종양 세포를 인식하고 죽이는 새로운 유형의 세포 면역 요법 기술입니다. 미국 FDA가 처음으로 CD19 표적 CAR-T 세포 요법을 승인한 이후 CAR-T 세포 요법은 B세포 림프종 환자에게 전례 없는 치료 효과를 보여주었습니다 . 그러나 CAR-T 세포 치료의 놀라운 성과로 사이토카인 방출 증후군(CRS) 및 신경 독성과 같은 많은 전신 독성반응도 자주 보고되었습니다.
또한, CAR-T 세포의 복잡한 배양 공정은 표준 임상 치료로서 이 요법의 광범위한 적용을 제한합니다. 따라서 이러한 장벽을 극복하고 이 치료법이 더 많은 환자에게 혜택을 줄 수 있도록 새로운 CAR-T 세포 패러다임을 개발하는 것이 시급합니다.
CAR-T 세포의 복잡한 제조 공정을 단순화하기 위해 건강한 사람의 동종이계 CAR-T 세포가 임상 시험에서 테스트되었습니다. CAR-T 세포는 자가 T 세포가 환자에게서 분리될 때까지 기다리지 않고 일반 약물처럼 쉽게 사용할 수 있으며 환자에게 주입할 수 있습니다. 그러나 지난해 셀렉티스의 제네릭 CAR-T 치료제 UCARTCS1A 임상시험 중 사망으로 동종이계 CAR-T 세포의 안전성에 대한 우려가 제기됐습니다. FDA는 또한 최근 안전성 문제로 인해 동종의 CAR-T 세포에 대한 임상 시험을 중단했습니다. 따라서 관련 독성을 극복하고 현재 CAR-T 세포 치료제의 제조 공정을 단순화하기 위한 새로운 전략이 필요합니다.
자가 CAR-T 세포의 프로그래밍은 종양 세포의 표적을 강화하고 사이토카인 방출 증후군(CRS) 및 신경독성과 같은 전신 독성을 감소시킬 수 있습니다. 표준화된 방법으로 쉽게 제조할 수 있습니다. 생체 내에서 유도된 CAR-T 세포는 CAR-T 세포 요법의 현재 장벽을 극복할 수 있는 잠재적 솔루션을 제공합니다.
CAR 구조 및 진화
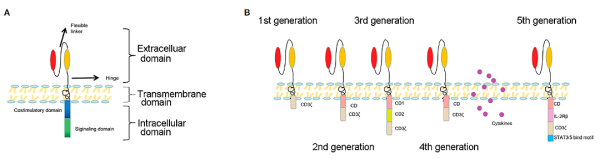
키메라 항원 수용체(CAR)의 구조는 항원 결합 및 세포내 신호를 포함하는 모듈식 디자인을 가지고 있습니다
(그림 1A). 항원 결합은 일반적으로 악성 암세포 표면의 항원에 결합할 수 있는 단일 클론 항체 유래 단편(scFv) 분자이며, CAR을 T 세포막에 고정시키는 역할을 합니다. 세포 내 신호 전달은 일반적으로 T 세포 수용체 CD3ζ 사슬에서 파생된 T 세포 활성화된 CD28 또는 4-1BB 영역을 포함하는 티로신 기반 면역 수용체 활성화 모티브로 구성되는 공동 자극 도메인(또는 CD137 및 TNFRSF9)입니다. CAR 구조의 각 구성 요소의 변형을 통해 최종 CAR-T 세포의 기능 및 항종양 활성을 미세 조정할 수 있습니다.
CAR-T 세포 요법의 안전성과 효능을 개선하기 위해 다양한 CAR 구조가 설계되었습니다. 설계된 CAR 유전자가 T 세포에 통합되면 T 세포 표면의 scFv는 종양 관련 항원을 특이적으로 인식하고 CAR-T 세포를 종양 세포에 결합시킵니다. 그 후, CAR-T 세포의 세포내 신호 전달 도메인이 활성화되어 CAR-T 세포가 증식하고 종양 세포를 죽이는 사이토카인을 분비합니다.
펜실베니아 대학의 Carl June 박사와 필라델피아 어린이 병원의 David Porter박사가 2011년에 처음으로 CAR-T 세포를 임상 치료에 적용한 이후로 CAR 구조는 5세대에 걸친 개발을 거쳤습니다(그림 1B). 1세대 CAR은 세포내 자극 도메인과 세포외 단일 사슬 항체를 포함합니다 공동 자극 분자가 없기 때문에 이 세대의 CAR-T 세포는 계속 증식할 수 없습니다. 2세대 CAR은 CD28 또는 4-1BB(CD137)와 같은 공동 자극 분자를 추가하여 CAR-T 세포 증식을 강화하고 독성을 줄입니다. 가장 초기에 승인된 두 가지 CAR-T 세포 치료제인 Yescarta™ 및 Kymriah™는 각각 CD28 및 4-1BB를 포함하는 2세대 CAR-T 세포입니다. 3세대 CAR에는 CD27, CD28, 종양 괴사 인자 수퍼패밀리 4(OX40, CD134로도 알려짐), 4-1BB(CD137) 또는 CD244와 같은 두 개의 공동 자극 분자가 포함됩니다. 4세대 CAR은 TRUCKs라고 불리며 CAR-T 세포의 직접적인 항종양 능력과 전달된 사이토카인의 면역 조절 기능을 결합합니다. TRUCK는 IL-7, IL-12, IL-15, IL-18, IL-23 및 이들의 조합을 포함한 다양한 사이토카인을 사용하여 초기 임상 시험에 진입했습니다. 5세대는 추가 막 수용체를 통합하여 항원 의존 방식으로 CAR-T 세포의 활성화를 제어합니다.
그림 1A: CAR의 기본 구조, 그림 1B: 5세대 CAR 개발
CAR 구조에 새로운 기능성 분자를 추가하는 것 외에도 많은 연구에서 새로운 CAR 구조에 대한 대체 종양 표적 부위를 선택했습니다. CD30은 호지킨 림프종 악성 세포에서 매우 강하게 발현되고 건강한 림프구 및 조혈 줄기/전구 세포(HSPC)에서 약하게 발현됩니다. CD30 CAR-T 세포 요법은 CD30+ 악성 종양 치료에서 탁월한 결과를 보인 반면 건강한 활성화 림프구와 HSPC는 영향을 받지 않았습니다. CD20은 B 세포의 발생 및 분화에 기여하는 33-37-kDa 비-당화 단백질이며, CD20은 후기 pre-B 세포 및 성숙한 B 세포에서 높게 발현되지만, 열 충격을 받은 세포의 표면에서 발현됩니다. CD20 CAR-T 세포 요법은 B세포 비호지킨 림프종의 치료에 유망한 것으로 나타났으며 현재 재발성 또는 불응성 CD20 양성 만성 림프구성 백혈병 환자에게 고려되고 있습니다. Lym-1은 인간 B세포 림프종 표면에 있는 인간 백혈구 항원 D 관련 항원(HLA-DR)의 구조적 에피토프를 표적으로 합니다. 악성 B 세포에 대한 Lym-1의 결합 친화력은 정상 B 세포보다 높으며 Lym-1 CAR-T 세포는 B 세포 림프종에 대해 강력한 항종양 효과를 나타냅니다. 일부 대체 표적 부위는 CD19와 결합되어 이중 표적 CAR-T 세포를 형성합니다. 예를 들어, CD37과 CD19를 하나의 CAR로 결합하면 CD19와 CD37을 개별적으로 또는 동시에 인식할 수 있는 이중특이성 CAR-T 세포가 생성됩니다. CD79b는 또한 CD19에 대한 보완적인 개념입니다. CD19 및 CD79 이중특이적 CAR-T 세포는 일부 표적에 종양 세포 및 종양 미세 환경에 작용하는 표적 기능이 있습니다. 예를 들어, CD123은 호지킨 림프종 세포와 종양 관련 대식세포 모두에서 발현되므로 CD123 내성 CAR-T 세포는 두 유형의 세포를 공동 표적으로 삼아 동시에 죽일 수 있습니다.
CAR 구조는 현재 CAR-T 세포 요법의 효능을 개선하기 위해 진화하고 있습니다.
현재 CAR-T 세포 요법이 넘어야할 목표
2017년부터 2021년까지 FDA는 아래 표와 같이 5개의 CAR-T 세포 치료제를 마케팅용으로 승인했습니다.
FDA 승인을 받은 CAR-T 세포치료제 5종
Kymriah™(Tisagenlecleucel)는 특정 유형의 B세포 림프종을 가진 성인 환자를 위해 FDA가 승인한 최초의 CAR-T 세포 치료제입니다. 세 가지 승인된 CAR-T 세포 제품 Yescarta™(Axicabtagene ciloleucel), TecartusE™(Brexucabtagene autoleucel) 및 Breyanzi®(Lisocabtagene maraleucel)도 B세포 림프종 치료용으로 승인되었습니다. 다섯 번째 CAR-T 세포 제품인 Abecma®(Idecabtagene vicleucel)는 다발성 골수종 치료에 사용됩니다.
5개의 승인된 CAR-T 세포 제품 외에도 많은 수의 CAR-T 세포가 임상 시험에서 운영되고 있지만 현재 CAR-T 요법은 관련 독성, 면역 억제 종양 미세 환경 및 복잡한 제조 공정과 같은 몇 가지 장애물이 있습니다.
현재 CAR-T 요법과 관련된 주요 독성에는 사이토카인 방출 증후군(CRS, 사이토카인 폭풍이라고도 함), 면역 이펙터 세포 관련 신경 독성 증후군(ICANS) 및 비종양 표적 독성이 포함됩니다. CRS는 CAR-T 세포 치료 후 IL-6, IL-10, IL-2 및 TNFα와 같은 많은 수의 염증성 사이토카인의 생성으로 인해 발생합니다. CRS는 종종 발열, 저혈압, 저산소증, 장기 기능 장애 및 심지어 생명을 위협하는 부작용을 유발합니다. 심각하거나 생명을 위협하는 CRS의 발병률은 25%에 달할 수 있습니다. ICANS는 신경학적 이상 및 후유증을 특징으로 하는 CAR-T 세포 치료와 관련된 또 다른 일반적인 독성으로, 일반적으로 CAR-T 세포 치료 후 1주 이내에 발생합니다. ICANS의 일반적인 부작용으로는 실어증을 동반한 독성 뇌병증, 착란, 단어 찾기 어려움 등이 있습니다.
비종양 표적 독성은 CD19 CAR-T 세포가 CD19+를 박멸하기 때문에 CD19 CAR-T 세포가 악성 B 세포 환자에게 투여될 때 정상 세포와 악성 세포 모두에서 표적 단백질의 발현으로 인한 것입니다. B 세포 전구체, 비종양 표적 효과는 B 세포 무형성증을 유발하고 저감마글로불린혈증을 유발합니다.
MVT(면역억제성 종양 미세환경)는 CAR-T 세포의 활성화를 억제하고 T 세포의 고갈을 가속화하는데, 면역억제성 MVT의 불리한 요인으로는 저산소증, 다양한 면역억제 세포, 공동억제 수용체의 지속적인 발현 등이 있습니다. 저산소증은 종양 MVT에서 저산소증으로 정의되었습니다. 종양 MVT의 면역억제 세포에는 조절 T 세포(Treg), 종양 관련 대식세포(TAM) 및 골수 유래 억제 세포(MDSC)가 포함됩니다.
현재 CAR-T 세포의 제조 공정은 T 세포 채취, 유전자 변형 및 확장, 환자에게 다시 주입하는 등 매우 복잡한 작업입니다. CAR-T 세포의 현재 제조 배양은 비용이 많이 들고 기술 집약적이어서 이 새로운 치료법을 필요로 하는 많은 암 환자들이 이를 얻기가 어렵습니다.
CAR-T 세포 치료의 유전자 편집 도구
CAR-T 세포 치료에 일반적으로 사용되는 유전자 편집 도구에는 ZFN, TALEN 및 CRISPR-Cas9 기술이 포함됩니다. ZFN은 널리 사용되는 유전자 편집 도구의 1세대로 효과적이고 특정한 유전자 편집을 달성할 수 있지만 표적 단백질 분자를 최적화하는 데 오랜 시간이 걸립니다. 2세대 유전자 편집 도구인 TALEN은 ZFN보다 경제적이지만 여전히 시스템을 최적화하는 데 오랜 시간이 걸립니다. CRISPR-Cas9 기술은 단순성, 효율성 및 특이성으로 인해 가장 인기 있는 유전자 편집 도구가 되었습니다.
CRISPR-Cas9로 대표되는 유전자 편집 기술의 발달로 CAR-T 세포의 정밀한 유전자 편집이 가능해 T세포의 PD-1을 제거해 T세포를 생성할 수 있게 됐습니다. CRISPR-Cas9는 또한 CD33 및 CD7과 같은 정상 세포의 내인성 항원을 제거하여 리디렉션된 T 세포의 비종양 표적 독성을 감소시키는 데 사용되었습니다.
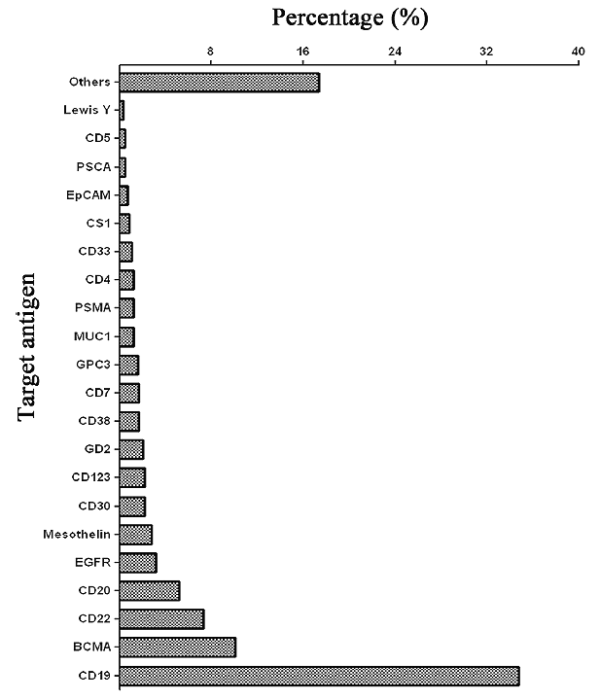
현재 CRISPR-Cas9 시스템은 최소 21개의 표적 항원에 대한 CAR-T 임상 시험에 사용되었으며, 그 중 CD19와 BCMA의 두 표적이 거의 절반을 차지합니다. CAR-T 세포를 편집하기 위해 CRISPR-Cas9 시스템을 더 광범위하게 사용하려면 효율적인 전달 방법을 개발해야 합니다.
2021년 6월 데이터, 미국에 등록된 임상시험 만 집계
CRISPR-Cas9 유전자 편집 기술을 이용한 CAR-T 세포 치료용 표적 항원
유전자 전달 시스템
유전자 편집 도구 및 CAR 유전자의 전달을 포함하여 유전자 치료 제품을 전달하기 위해 여러 가지 전달 시스템이 사용되었습니다.
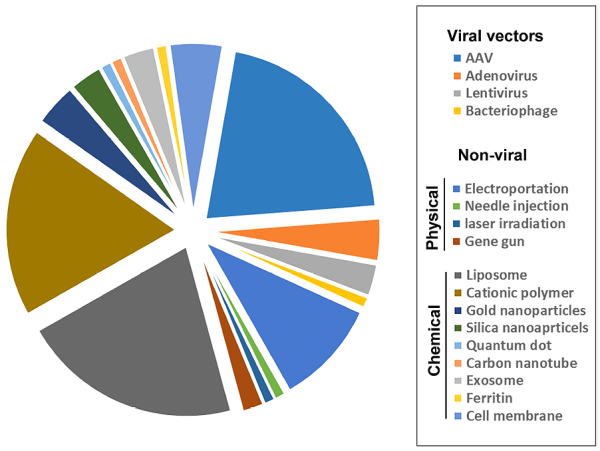
다양한 바이러스 벡터 및 비 바이러스 벡터
바이러스 벡터는 형질감염 효율이 가장 높고 유전자 전달에 널리 이용되지만 면역원성, 세포독성 등의 문제가 있습니다. 아데노 관련 바이러스(AAV)는 다른 바이러스 벡터(예: 렌티바이러스 및 아데노바이러스)보다 독성 위험이 낮지만 AAV 벡터는 다른 바이러스 벡터보다 로드 크기가 작고 5kb 미만의 DNA 단편만 전달할 수 있습니다.
바이러스 벡터 외에도 물리적 기술과 화학 기술의 두 가지 범주로 나눌 수 있는 비 바이러스 전달 시스템도 있습니다. 가장 널리 사용되는 유전자 전달 방법 중 하나인 Electroporation은 전기 펄스를 사용하여 세포막의 기공 형성과 유전자의 일시적 투과성을 유도합니다. 물리적 기술은 낮은 면역원성으로 매력적인 유전자 전달 방법이지만 이 방법은 내부 장기를 표적으로 할 수 없습니다. 유전자 전달에 사용되는 화학적 기술로는 주로 양이온성 지질 또는 고분자 기반 나노입자, 금나노입자, 실리카 나노입자, 탄소나노튜브, 엑소좀, 페리틴, 원형질막 등이 있습니다.
지질 기반 나노입자는 가장 매력적인 비바이러스 유전자 전달 비히클 중 하나이며, 이러한 비히클은 여러 제제에서 임상 용도로 승인되었습니다. 특히 지질 나노입자(LNP)는 mRNA COVID-19 백신을 전달하는 데 성공적으로 사용되었습니다. LNP는 또한 CRISPR-Cas9 시스템을 전달하는 데 사용되어 임상 시험에서 강력한 유전자 편집 및 치료 효과를 달성했습니다. 폴리머 기반 나노입자는 또 다른 적합한 유전자 전달 시스템이며 양전하 폴리머는 세포막을 파괴하고 엔도좀 탈출을 가능하게 하는 유전자와 안정적인 멀티머를 형성할 수 있습니다. 폴리머 기반 나노입자의 한계는 양전하 표면과 음전하 세포막 및 혈액 순환 단백질의 상호 작용으로 인한 독성 및 면역원성입니다.
엑소좀은 자연적으로 분비되는 나노미터 크기의 세포외 소포로, 자연적인 생체적합성과 최소한의 면역 제거로 인해 유전자 전달 수단으로 광범위하게 연구되고 있습니다. 그러나 엑소좀을 유전자 전달 벡터로 활용하기 위해서는 생산, 분리, 정제 등의 어려움을 극복해야 하며, 여전히 많은 과제가 남아 있습니다. 혈소판과 적혈구의 원형질막은 유전자 전달을 위한 생체복사 운반체로서 자연적인 생체적합성과 표적화를 가지고 있지만 형질감염에 대한 효율을 개선해야 합니다. 다른 나노운반체는 모두 유전자 전달에 미치는 영향을 결정하는 고유한 특성을 가지고 있습니다. 일부는 다양한 질병의 치료에 잠재적인 효능을 보였지만 최적의 약물 전달 시스템은 아직 임상 적용을 달성하지 못했습니다.
현재 CAR-T 세포의 제조 배양기술은 전문 장비와 많은 기술 축적을 필요로 하고 있습니다.
생산 공정을 단순화하기 위해 동종이계 건강한 사람에서 CAR-T 세포를 임상시험에서 테스트했지만, 동종 CAR-T 세포에 대한 안전성 문제로 인해 FDA는 최근 동종이계에서 CAR-T 세포를 중단했습니다.
나노입자를 통한 CAR-T 세포의 생체 내 프로그래밍은 체외에서 CAR-T 세포의 복잡한 제조 공정을 단순화하고 표준화하는 새로운 접근 방식입니다.
또한 CAR-T 세포의 원상태 유도는 CRS(cytokine release syndrome) 및 ICANS(immune effector cell-associated neurotoxicity syndrome)와 같은 전신 독성을 효과적으로 감소시킬 수 있습니다.
이미 2017년과 2020년에 미국 Fred Hutchinson Cancer Research Center의 Matthias Stephan 교수는 Nature Nanotechnology 및 Nature Communications 저널에 논문을 발표했습니다[2, 3]. CAR-T 세포는 나노캐리어를 통해 CAR-DNA 또는 CAR-mRNA를 전달함으로써 생체 내에서 유도되었습니다. 두 작업 모두에서 나노전달 시스템의 핵심은 양이온 폴리머 폴리(베타-아미노에스테르)로 구성되었으며 CD19를 표적으로 하는 2세대 CAR 구조로 조립되었습니다. 나노 전달 시스템의 외부는 항-CD3 항체와 결합된 폴리글루탐산(PGA)으로 만들어집니다. CD19 특이적 CAR 유전자를 지닌 고분자 나노입자는 생체 내에서 신속하고 특이적으로 T 세포를 편집했고, 전신 독성을 일으키지 않으면서 기존 실험실에서 만든 CAR-T 세포와 비슷한 항종양 효과를 가져왔습니다.
Christian Buchholz 등은 면역결핍 NOD-scid-IL2Rc null(NSG) 연구에서 2세대 항-CD19-CAR 유전자 래핑 렌티바이러스가 반복적인 CAR-T 세포를 유도하고 항종양 활성을 보였다고 처음으로 보고했습니다. 그들의 연구에서 CAR 양성 NK 및 NKT 세포가 예기치 않게 검출되었는데, 이는 렌티바이러스 벡터의 비특이성 때문일 수 있습니다.
바이러스 벡터의 비특이성을 극복하기 위해 Samuel K Lai 등은 CAR-T 세포의 생체 내 특이적 엔지니어링을 위해 렌티바이러스 벡터를 T 세포로 리디렉션하는 이중특이성 결합제를 개발했습니다. 그들은 렌티바이러스에 의해 조작된 생체 내 CAR-T 세포가 항종양 활성을 가지고 있지만 CAR을 발현하는 T 세포의 수는 상대적으로 적다는 것을 관찰했습니다. 그들은 생체 내 CAR-T 세포가 생체 외 CAR-T 세포보다 더 나은 성능과 자가 재생 복제 능력을 가지고 있다는 가치 있고 입증되지 않은 이론을 입증한다고 믿습니다.
바이러스 벡터 중 아데노 관련 바이러스(AAV)의 독성 위험은 낮습니다. AAV에 의해 인코딩된 CAR 유전자는 생체 내에서 CAR-T 세포를 생성하기 위한 면역 이펙터 세포의 충분한 재프로그래밍일 수 있습니다. 이 작업에서 그들은 생체 내에서 CAR-T 세포를 유도하는 AAV의 개념을 시연했지만 CAR 유전자를 운반하는 AAV의 비특이성에 대한 우려도 발표했습니다. 바이러스 벡터의 비특이성 외에도 바이러스 벡터의 또 다른 일반적인 안전 문제는 염색체에 유전자가 무작위로 삽입될 수 있다는 것입니다.
CRISPR과 같은 정확하고 빠른 유전자 편집 기술은 연구 내에서 CAR-T 세포를 생성하는 데 널리 사용되었습니다. CRISPR을 이용한 in vivo 유전자 편집에 대한 연구는 많지만 in vivo에서 CAR-T 세포를 생성하기 위한 CRISPR의 적용에 대한 보고는 없다. 유전자 편집 도구와 CAR 유전자를 결합한 미래의 애플리케이션은 생체 내 CAR-T 세포의 임상 적용을 가속화할 것입니다.
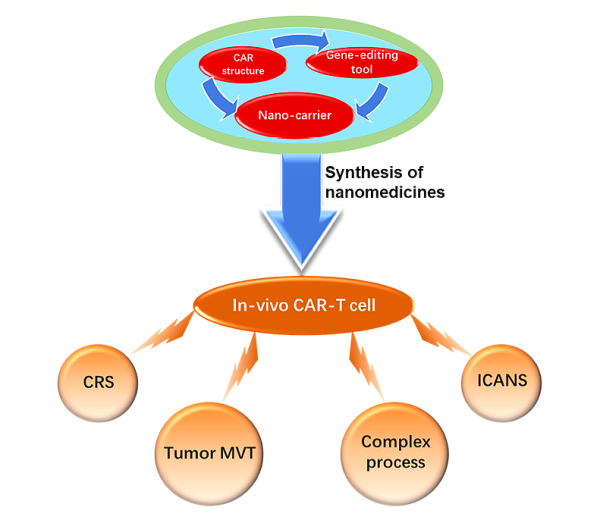
CAR-구조 및 유전자 편집 도구로 설계된 나노캐리어 전달은 생체 내에서 여러 기능을 가진 CAR-T 세포의 형성을 유도하여 관련 독성 효과, 면역 억제 미세 환경 및 복잡한 제조 공정과 같은 현재 CAR-T 세포의 장애물을 극복할 수 있습니다.
CAR 구조에 특별한 사이토카인 유전자를 추가하면 CAR-T 세포가 사이토카인을 분비하고 면역억제성 미세환경을 개선해 T 세포의 생존과 증식에 적합하도록 발전합니다. CAR 구조물의 유전자 편집 도구를 나노입자에 적용하면 면역 체크포인트 유전자를 제거할 수 있어 T 세포 고갈을 차단 시킬 수 있습니다. 더 중요한 것은 이 방법이 연구 내 CAR-T 세포 제조 공정의 표준화 및 확장 문제를 해결한다는 것입니다. 궁극적으로 CAR-T 세포 치료제는 나노 전달 벡터를 통해 기존 약물처럼 편리하게 생산, 보관 및 사용할 수 있습니다
나노 전달 시스템 기반의 체외 CAR-T 생성과 생체 내 CAR-T 생성 비교
결론 및 전망