2023년 11월 CAR-T치료 논문 발표
페이지 정보
작성자 PnH 조회88회 작성일 24-05-31 03:12본문
CAR-T (Chimeric Antigen Receptor T-Cell Immunotherapy)는 키메라 항원 수용체 T세포 면역치료제 입니다 . 이 치료법은 수년 동안 사용되어 왔지만 최근 몇 년간 임상적으로 개선되어 사용된 새로운 유형의 세포 치료법입니다. 급성 백혈병 과 비호지킨 림프종 치료에 상당한 효능이 있으며 가장 유망한 암 치료법 중 하나입니다. 모든 기술과 마찬가지로 CAR-T 기술도 오랜 진화 과정을 거쳐 왔으며, 이러한 일련의 진화 과정을 거치면서 CAR-T 기술도 점차 발전해왔습니다.
이 새로운 치료 전략의 핵심은 표적 세포를 인식하고 환자의 T세포가 CAR을 발현하도록 유전적으로 변형된 키메라 항원 수용체(CAR)라는 인공 수용체입니다. 임상 시험에서 연구원들은 혈액 투석과 유사한 과정을 통해 환자로부터
일부 T 세포를 추출한 다음 배양실에서 이를 유전적으로 변형하고 이 T 세포가 이 새로운 수용체를 발현할 수
있도록 이 CAR을 암호화하는 유전자를 도입했습니다. 이러한 유전적으로 변형된 T 세포는 배양실에서 증식된 다음 환자에게 다시 주입됩니다. 이러한 T 세포는 자신이 발현하는 CAR 수용체를 사용하여 표적 세포 표면의 분자에 결합하고, 이 결합은 내부 신호를 촉발하여 T 세포를 매우 강력하게 활성화시켜 표적 세포를 빠르게 파괴합니다.
최근에는 급성 백혈병, 비호지킨 림프종 치료에 사용되는 것 외에도 CAR-T 면역요법도 개선되어 고형 종양, 자가면역 질환, HIV 감염, 심장 질환 및 기타 질병 치료에 사용되며 적용 범위가 넓어졌습니다.
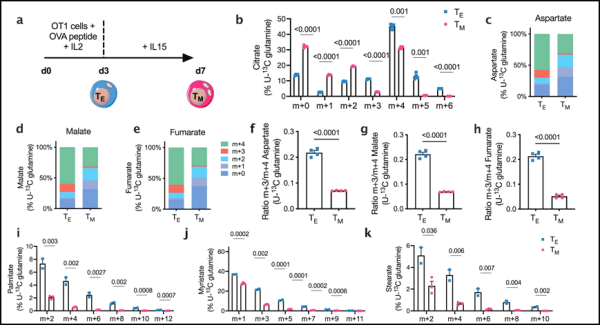
1. Nature: Reductive carboxylation epigenetically instructs T cell differentiation
기존 면역치료제 중 CAR-T 세포치료제는 특정 혈액암에 대해 매우 효과적인 것으로 나타났으나 환자의 일부에서만
효과가 있는 것으로 나타났습니다. 주된 이유 중 하나는 배양 내에서 조작된 이러한 T 세포가 조기 기능 장애를 일으킨다는 것입니다.
제네바 대학, 로잔 대학, 제네바 대학 병원, 스위스 보 대학 병원의 연구자들은 새로운 연구에서 CAR-T 세포의 기능을 연장하는 방법을 발견했습니다. 매우 특정한 대사 메커니즘을 억제함으로써 그들은 종양 세포와 더 오랫동안 싸울 수 있는 향상된 면역 기억을 가진 CAR-T 세포를 성공적으로 만들었습니다.
이러한 매우 유망한 결과는 "Reductive carboxylation epigenetically instructs T cell differentiation"라는 제목으로 2023년 9월 20일 Nature 저널에 온라인으로 게재되었습니다.
Nature, 2023, doi:10.1038/s41586-023-06546-y.
논문의 공동 교신저자이자 제네바 대학교 의과대학 연구원인 Mathias Wenes는 "CAR-T 세포는 투여되기 전에 대량으로 증식해야 합니다. 그러나 환자의 병력이 이와 결합되어 증식 과정은 이러한 세포를 소진시킵니다. 세포는 생존 여부를 결정할 시간을 남기지 않고 최종 분화 상태에 도달합니다."
산소가 없으면 암세포는 매우 특정한 생존 메커니즘으로 전환됩니다. 즉, 대체 에너지원으로 아미노산의 환원된 carboxylation라는 화학 반응을 통해 글루타민이라는 화학 물질을 대사합니다.
Wenes는 "환원된 carboxylation의 역할을 연구하기 위해 저자들은 두 가지 혈액암, 백혈병 및 다발성 골수종의 실험 모델에서 CAR-T 세포의 이 대사 메커니즘을 억제했습니다. 우리가 조작한 CAR-T 세포는 정상적으로 증식했고 그 기능을 잃지 않았습니다."
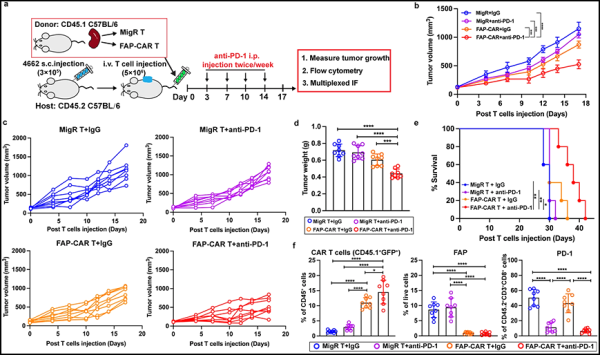
2. Nat Commun: 종양 미세환경에서 CAF 세포의 표적화를 통해 CAR-T 세포가 고형 종양을 보다 효과적으로 치료할 수 있을 것으로 기대됩니다.
새로운 연구에서 펜실베니아 대학의 연구자들은 종양 미세 환경이 T 세포가 종양을 공격하는 것을 어떻게 방지하는지 밝혀냈습니다. 실험 모델을 이용해 종양 미세환경의 암관련섬유아세포(CAF)와 세포외기질이 T세포 진입에 물리적 장벽을 형성하고 있으며, 이들 CAF 세포도 T세포 진입을 적극적으로 억제하는 기능을 한다는 사실을 확인했습니다. 종양 세포 자체를 표적으로 삼는 대신 CAF 세포를 표적으로 삼기 위해 CAR-T 세포를 사용했을 때, T 세포는 종양에 침투하여 공격할 수 있었습니다.
관련 연구 결과는 2023년 8월 22일 Nature Communications 저널에 게재되었습니다.
논문 제목은 "Desmoplastic stroma restricts T cell extravasation and mediates immune exclusion and immunosuppression in solid tumors."입니다.
Nature Communications, 2023, doi:10.1038/s41467-023-40850-5
논문의 제1저자이자 펜실베니아 대학 수의과대학 박사후 연구원인 Zebin Xiao는 "CAF 세포가 생성한 물리적 장벽과 면역억제 환경은 T 세포를 제한하거나 가두어 종양에 들어가는 것을 방지합니다. CAF 세포를 표적으로 삼으면 이 장벽을 파괴할 수 있으며 종양 억제 효과가 매우 큽니다."
일부 실험에서 저자들은 고형 종양을 치료하기 위해 CAF 세포를 표적으로 하는 CAR-T 세포를 사용한 다음 종양
항원 메조텔린을 표적으로 하기 위해 유전자 변형된 또 다른 CAR-T를 사용하여 종양에 대한 세포 치료법을 제시했습니다. 메조텔린 표적화 CAR T 세포는 배양내에서 암세포를 표적화하는 데 효과적이지만, 이전의 임상 시험에서는 환자의 고형 종양 치료에 덜 효과적인 것으로 나타났습니다. 이러한 T 세포가 기능할 수 있는지 확인하고 싶었고 결과는 실제로 그렇게 한다는 것을 보여주었습니다. CAR-T 세포로 치료한 후 메조텔린 표적 CAR-T 세포는 종양에 들어가 기능을 발휘할 수 있습니다.
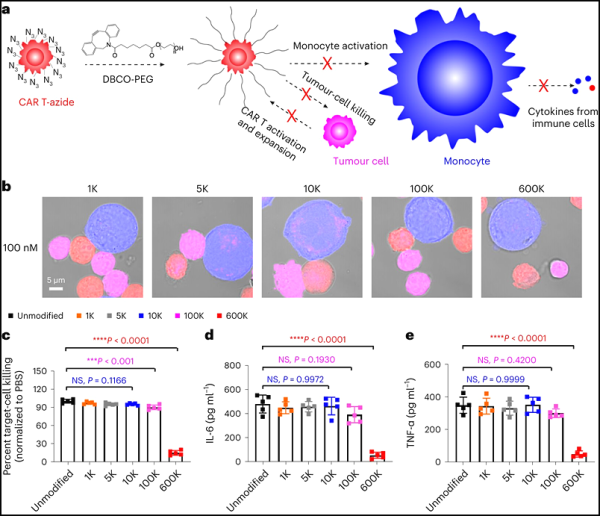
3. Nat Mater: CAR-T 세포치료에 PEG 변형으로 사이토카인 방출 증후군 및 신경 독성을 완화합니다.
6가지 CAR-T 세포 치료법이 미국 식품의약국 ( FDA ) 의 승인을 받았으며 몇 가지가 더 개발 중입니다. 그러나 이러한 세포 치료법에는 심각하고 잠재적으로 치명적인 부작용, 즉 사이토카인 방출 증후군(CRS) 및 신경 독성도 있습니다.
이러한 부작용은 고열 및 구토부터 다발성 장기 부전 및 환자 사망에 이르기까지 다양한 증상으로 나타나며 더 넓은 임상 적용에 큰 어려움을 안겨줍니다.
이제 새로운 연구에서 펜실베니아 대학의 연구자들은 심각한 부작용을 최소화하면서 CAR-T 세포 치료의 잠재력을 최대한 발휘하는 데 도움이 될 수 있는 솔루션을 발견했습니다.
관련 연구 결과는 'In situ PEGylation of CAR T cells alleviates cytokine release syndrome and neurotoxicity'라는 제목으로 네이처 머티리얼즈(Nature Materials) 저널에 2023년 9월 11일 온라인 게재됐습니다.
논문의 교신저자는 펜실베이니아 대학교 공학 및 응용과학부 부교수인 Michael Mitchell 박사입니다.
Nature Materials, 2023, doi:10.1038/s41563-023-01646-6 .
Mitchell은 "생체 내에서 CAR-T 세포와 대식세포의 상호작용을 제어하는 것은 매우 어렵습니다. 그래서 우리 연구에서는 CAR-T 세포 표면에 단당 분자를 추가하는 재료 공학 기반 전략을 도입했습니다. 분자는 반응 핸들 역할을 하여
신체의 세포 주위에 직접 생체 물질 코팅을 형성하며, 이는 '방어막'처럼 작용하고 대식세포와의 위험한 상호 작용을 방지합니다."
논문의 공동 제1저자이자 Mitchell 연구소의 박사후 연구원인 Ningqiang Gong은 이 기술을 자세히 소개했습니다.
"우리는 대사 표지 기술을 사용하여 단당 분자를 CAR-T 세포에 부착합니다. 이 변형을 통해 CAR-T 세포가 공 박사는 CRS 증상이 나타나기 시작하면 또 다른 분자인 폴리에틸렌 글리콜(PEG)을 도입해 유전자 변형 세포를 효과적으로 차단하는 방어구를 만든다”고 공 박사는 말했습니다."
시간이 지남에 따라 작은 종양 항원은 "PEGylated CAR T 세포"에 여전히 도달하여 이와 관련된 빠른 활성화 및 확장을 유발하지 않고 천천히 활성화하고 확장할 수 있으며, 이와 관련된 심각한 부작용이 있습니다. CAR-T 세포가 천천히 확장됨에 따라 PEG의 표면 밀도가 희석되어 다른 세포와 상호 작용하는 능력이 점차 회복됩니다.
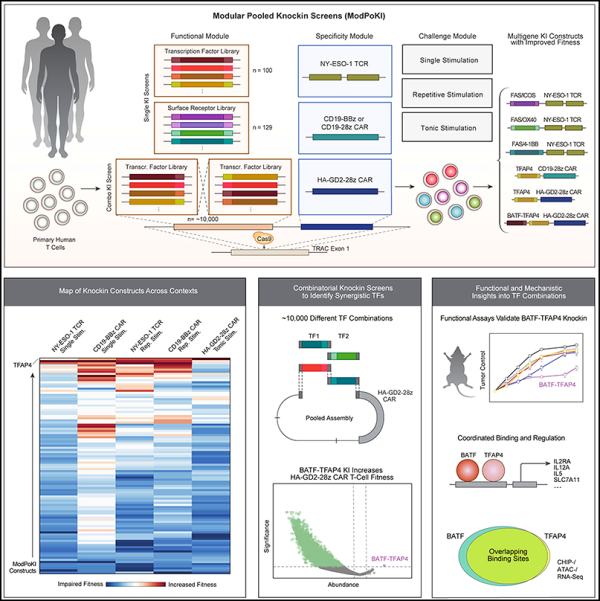
4. 셀(Cell): 유전자 편집 도구 개발---ModPoKI, CAR-T 세포 치료 개선 기대
이제 새로운 연구에서 글래드스톤 연구소(Gladstone Institutes)와 샌프란시스코 캘리포니아 대학교(University of California, San Francisco)의 연구원들은 수천 가지의 다양한 유전자 편집 조합을 신속하게 "조립"하여 면역 세포에서 테스트할 수 있는 기술을 개발했습니다. 스크리닝 기술을 사용하여 면역 세포에 추가되면 이러한 유전자를 세포의 수명을 연장시키고 더 나은 항암 효과를 나타낼 수 있는 새로운 유전자 조합을 식별했습니다. 관련 연구 결과는 'Modular pooled discovery of synthetic knockin sequences to program durable cell therapies'이라는 제목으로 Cell 저널에 2023년 9월 14일 게재되었습니다.
Cell, 2023, doi:10.1016/j.cell.2023.08.013
논문의 공동 교신저자이자 글래드스톤-UC 샌프란시스코 게놈 면역학 연구소 소장인 알렉산더 마슨(Alexander Marson) 박사는 이렇게 말했습니다. 그리고 이것이 환자에게 어떻게 도움이 되는지 테스트하는 것이 더 나은 세포 치료법의 개발을 가속화할 것이라고 생각합니다."
공동 저자이자 스탠포드 대학교 의과대학 병리학과 조교수인 Ansuman Satpathy 박사는 "이 새로운 연구는 처리량이 높은 유전체학을 사용하여 세포 치료에서 새로운 분자 프로그램을 발견하고 설계할 수 있는 능력을 보여줍니다. 그리고 이러한 과정에 대한 우리의 이해를 더욱 발전시킵니다.
이 저자들은 ModPoKI를 개발했습니다. 이 기술은 CRISPR 유전자 편집 플랫폼에 사용하기 위해 여러 유전자를 긴 DNA 조각으로 결합합니다. 그들은 이 도구를 사용하여 수백 개의 유전자를 특정 CAR을 코딩하는 DNA와 함께 혼합함으로써 이러한 긴 DNA 길이의 약 10,000개의 잠재적인 조합을 만들었습니다. 그런 다음 그들은 CRISPR를 사용하여 함께 접합된 DNA 서열을 T 세포 게놈의 정의된 위치에 붙여넣었습니다.
각 T 세포는 서로 다른 DNA 서열을 받았으며, 저자는 항종양 활성을 예측할 수 있는 다양한 테스트에서 어떤 T 세포가 가장 잘 수행되는지 확인하기 위해 T 세포를 서로 맞붙였습니다. ModPoKI에서 생성된 각 유전자 세트에는 읽기 쉬운 DNA 바코드가 있어 어떤 유전자 조합이 T 세포를 향상시키는지 추적할 수 있습니다.
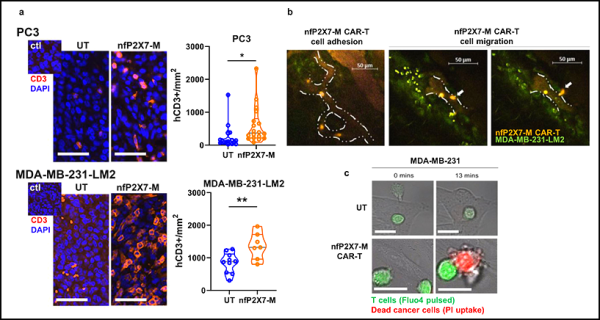
5. Nat Commun: nfP2X7을 표적으로 하는 CAR-T 세포는 고형 종양 치료를 위한 광범위한 암 면역요법이 될 수 있습니다
최근 호주 애들레이드대학교 연구진은 네이처 커뮤니케이션즈(Nature Communications) 저널에
'Pre-clinical validation of a pan-cancer CAR-T cell immunotherapy targeting nfP2X7'이라는 제목의 논문을 게재했습니다.
유방암과 전립선암의 이종이식 모델에서 nfP2X7을 표적으로 하는 CAR-T 세포는 강력한 항종양 효과를 나타냈습니다. 이러한 데이터는 nfP2X7이 종양에서 편재적으로 발현되기 때문에 적합한 면역요법 표적임을 시사합니다. nfP2X7을 표적으로 하는 CAR-T 세포는 고형 종양 치료를 위한 광범위한 암 면역요법이 될 가능성이 있습니다.
이 연구 결과는 여러 고형암 유형의 치료를 위한 새로운 면역요법으로서 CAR-T 세포를 표적으로 하는 nfP2X7의 잠재력을 분명히 강조합니다. 이 연구는 nfP2X7을 광범위하게 발현하는 고형 종양에 대한 세포 면역치료 표적으로 nfP2X7의 큰 잠재력을 처음으로 입증했으며, CAR-T 세포 모델은 단일클론 항체로 nfP2X7을 표적으로 삼는 기능적 대안을 제공할 수 있습니다. 실제로(예: 체크포인트 억제제, 방사선 요법, IL-2 투여) 없이 CAR T 세포만 투여받았거나 변형 없이 CAR T 세포만 투여받은 고형 종양에 대한 CAR T 세포 연구에서 NSG 에서는 종양 거부 또는 치유가 거의 보이지 않습니다. 종양 세포. nfP2X7 표적 CAR-T 세포의 임상 효능을 더욱 향상시키기 위한 접근법에는 표준 수술 및/또는 화학요법 요법 또는 체크포인트 억제제와의 공동 투여가 포함될 수 있습니다.
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.