2023년 Cell 9월 저널 발표 (2)
페이지 정보
작성자 PnH 조회103회 작성일 24-05-31 03:08본문
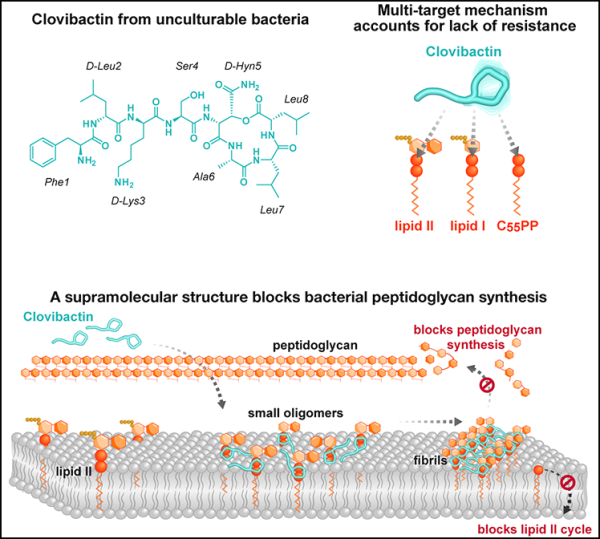
1.Cell: 클로로비박틴(Clolovibactin )은 세균의 저항성을 유발하지 않고 유해균을 효과적으로 공격할수 있습니다.
네덜란드 위트레흐트 대학교, 독일 본 대학교, 미국 노스이스턴 대학교 독일 감염 연구 센터, 제약회사 NovoBiotic의 연구진은 새로운 연구에서 다음과 같은 강력한 박테리아를 발견했습니다. 효과적인 항생제는 해로운 박테리아, 심지어 다제내성 "슈퍼박테리아"까지도 퇴치할 수 있는 것으로 보입니다. 클로로비박틴(Clolovibactin)이라는 항생제는 특이한 방식으로 박테리아를 죽여 박테리아가 내성을 키우는 것을 더 어렵게 만듭니다. 관련 연구 결과가 Cell저널에 2023년 9월 14일자 "An antibiotic from an uncultured bacterium binds to an immutable target"라는 제목으로 게재됐습니다.
2023, doi:10.1016/j.cell.2023.07.038
항생제 내성은 인류 건강이 직면한 주요 문제이며, 전 세계 과학자들은 새로운 해결책을 찾고 있습니다. 논문의 공동 교신저자이자 위트레흐트대학교 화학과 연구원인 마르쿠스 와인가르스(Markus Weingarth) 박사는 “임상적으로 사용되는 대부분의 항생제에 점점 더 내성을 보이는 박테리아를 처리하기 위해서는 새로운 항생제가 시급히 필요하다”고 말했습니다. 클로비박틴은 이전에 성장할 수 없었던 박테리아로부터 분리되기 때문에 질병을 일으키는 박테리아는 이전에 이 항생제를 본 적이 없으며 저항성을 키울 시간도 없었습니다."
클로비박틴의 살균 메커니즘의 독특한 특징은 표적의 가변 글리코펩타이드 부분을 무시하면서 세포벽 전구체 분자에서 흔히 발견되는 불변 피로인산염에만 결합한다는 것입니다. "클로비박틴은 표적의 불변적이고 보존된 부분에만 결합하기 때문에 박테리아가 이에 대한 저항성을 발달시키기가 더 어려울 것입니다. 실제로 우리는 이 새로운 연구에서 클로비박틴에 대한 어떠한 저항도 관찰하지 못했습니다."
2. Cell: RNA 연구를 위한 새로운 시스템 개발---COURIER
RNA 분자는 세포가 다양한 기능을 수행하는 데 사용하는 단백질을 만드는 지침이며 세포 내부에서 일어나는 일에 대한 정확한 단서를 제공할 수 있습니다. 그러나 현재의 최첨단 RNA 검출 기술은 세포를 분해해야 합니다. 즉, 세포를 깨뜨려 세포 내의 모든 분자를 수집하고 분석해야 합니다. 이는 과학자들이 세포가 죽기 바로 직전의 상태에 대한 스냅샷만 캡처할 수 있을 뿐 시간이 지남에 따라 세포가 어떻게 변하는지는 관찰할 수 없음을 의미합니다. 세포에서 RNA를 생물학적 과정을 연구하는 데 유용한 방법이지만 실제로 세포 내에서 RNA를 수정하거나 세포 행동에 영향을 주어 질병을 치료하는 강력한 도구입니다. 예를 들어, 몇몇 코로나19 백신은 메신저 RNA(mRNA)를 세포에 전달하여 코로나바이러스 SARS-CoV-2에 대한 항체 생성을 유도하는 방식으로 작동합니다. RNA는 다양한 질병에 대한 효과적인 치료법일 수 있지만 이를 올바른 세포에 전달하는 것은 어려운 일이었습니다.
Cell, 2023, doi:10.1016/j.cell.2023.06.013
이제 새로운 연구에서 캘리포니아 공과대학(California Institute of Technology)의 연구원들은 RNA 문제를 동시에 해결할 수 있는 시스템을 개발했습니다. 이 새로운 기술을 통해 과학자들은 시간이 지남에 따라 세포를 손상시키지 않고 RNA를 연구할 수 있으며, 배아 발달부터 암까지 수많은 세포 과정을 추적할 수 있는 새로운 방법을 제공합니다. 특히, 이 시스템은 세포를 편집하여 RNA를 다른 세포로 전달함으로써 세포를 특정 방식으로 행동하도록 설계할 수 있는 가능성을 열어 잠재적으로 새로운 치료 전략을 가능하게 합니다. 관련 연구 결과는 '살아있는 세포의 측정 및 조작을 위한 엔지니어링 RNA 추출기술'이라는 제목으로 Cell 저널에 2023년 8월 17일 게재되었습니다.
논문의 제1저자이자 공동 교신저자이자 Caltech의 박사후 연구원인 Felix Horns는 "생물학에는 많은 과정이 있으며 우리는 이러한 과정에서 시간이 지남에 따라 세포가 어떻게 변하는지 알고 싶습니다. 예를 들어 발달 중에 배아는 세포 상태를 변화시켜 다양한 조직으로 발달합니다. 암과 같은 많은 질병은 시간이 지남에 따라 변하며 확실히 노화도 시간이 지남에 따라 변합니다."
Horns는 “RNA의 핵심 역할은 세포에게 무엇을 해야 하는지 알려주는 것입니다. 세포에서 발현되는 RNA를 측정할 수 있다면 세포가 무엇을 하는지 이해할 수 있습니다. 게다가 지난 몇 년 동안 우리가 관찰한 것처럼 RNA 백신 형식을 사용하면 mRNA를 전달하여 세포에 지시를 내리고 세포의 행동을 프로그래밍할 수 있습니다."
Caltech의 생물학 및 생명공학 교수이자 논문의 공동 교신 저자인 Michael Elowitz는 "Engineering RNA export for measurement and manipulation of living cells"라고 말했습니다.
COURIER(Controlled Output and Uptake of RNA for Interrogation, Expression, and Regulation)라는 이름의 이 새로운 시스템은 세포에서 RNA를 내보낼 수 있습니다.
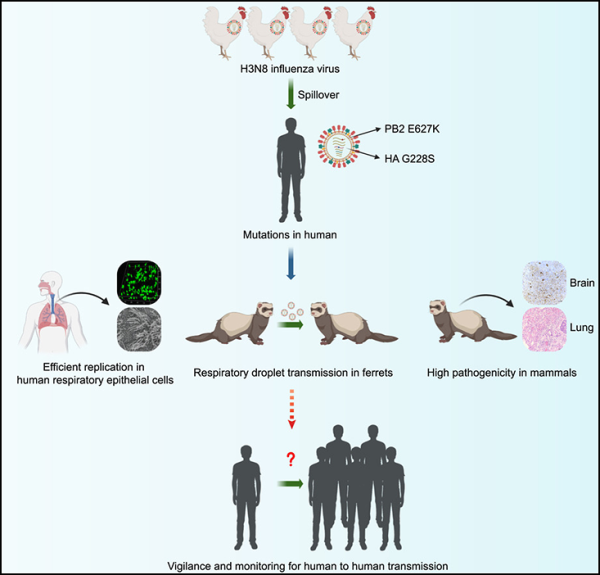
3 Cell: 중국 과학자들은 환자로부터 분리된 새로운 조류 인플루엔자 바이러스 H3N8이 비말을 통해 동물 간에 전염될 수 있다는 사실을 발견하였습니다.
중국 농업대학교, 중국과학원, 중국 질병통제예방센터, 영국 노팅엄대학교 연구진은 새로운 연구에서 중국 가금류 농장에서 유행하는 조류 인플루엔자 바이러스의 아형이 다음과 같다는 사실을 발견했습니다. 돌연변이로 인해 이 바이러스가 인간에게 전염될 위험이 높아질 수 있습니다. 이 발견은 잠재적인 전염병이나 전염병이 조장되고 있다는 우려를 불러일으키며, 가금류와 인간에서 그러한 바이러스를 면밀히 모니터링하기 위한 조정된 연구가 필요합니다. 관련 연구 결과는 'Airborne transmission of human-isolated avian H3N8 influenza virus between ferrets'이라는 제목으로 저널 셀(Cell)에 2023년 9월 4일 온라인 게재됐다. 논문의 교신저자는 중국 농업대학교 수의과대학의 Jinhua Liu 교수와 중국과학원의 George F. Gao 학자입니다.
논문의 첫 번째 저자는 중국 농업 대학교의 Honglei Sun, Han Li, Qi Tong, Qiqi Han 및 Jiyu Liu입니다.
2023, doi:10.1016/j.cell.2023.08.011
이 저자들은 인간 환자로부터 분리된 조류 인플루엔자 바이러스 아형 H3N8의 특성을 보고합니다. 실험실 쥐와 흰족제비를 인간 감염의 모델로 연구함으로써 그들은 H3N8이 심각한 동물 감염을 일으키고 공기를 통해 동물 사이에 퍼질 수 있도록 하는 여러 가지 적응을 겪는다는 것을 발견했습니다.
인간의 경우 H3N8 감염은 급성 호흡 곤란 증후군을 유발할 수 있으며 이는 치명적일 수 있습니다. 이 바이러스는 닭 떼에 널리 퍼져 있지만 이전에는 동물에서 인간으로 어떻게 전염되었는지에 대해 알려진 바가 거의 없었습니다.
이들 저자는 중증 폐렴 환자로부터 분리된 조류 인플루엔자 바이러스 H3N8이 인간의 기관지 세포와 폐 상피 세포에서 효율적으로 복제되고 실험실 포유류 숙주에 극도로 해로운 영향을 미치며 호흡기 비말을 통해 전염될 수 있음을 입증했습니다.
중요한 것은 바이러스가 공기 전염에 필요한 인간 수용체 결합 선호도와 아미노산 치환 PB2-E627K를 획득했다는 점입니다. 인간 H3N2 바이러스에 대한 예방접종을 하더라도, 새로 출현하는 포유류에 적응된 H3N8 조류 인플루엔자 바이러스에 대한 인간 면역은 약한 것으로 보이며 전염병 또는 전염병 규모의 감염에 취약할 수 있습니다.
4. Cell: Platyzoa를 사용하여 뉴런의 고대 기원을 밝히는 연구가 진행되고 있습니다.
새로운 연구에서 스페인 바르셀로나에 있는 게놈 조절 센터의 연구자들은 판형동물(placozoans)이라고 불리는 밀리미터 크기의 해양 동물 그룹에 초점을 맞춰 뉴런의 진화에 대한 새로운 시각을 제시했습니다. 그들은 이 독특한 고대 동물에서 발견된 특수 분비 세포가 더 복잡한 동물에서 발견되는 뉴런을 발생시켰을 수 있다는 증거를 발견했습니다.
관련 연구 결과는 2023년 9월 19일 Cell 저널에 온라인 게재됐습니다.
논문 제목은 'Stepwise emergence of the neuronal gene expression program in early animal evolution”입니다.
2023, doi:10.1016/j.cell.2023.08.027
저자들은 먼저 서로 다른 네 가지 종의 특징을 지적하면서 모든 다른 판티스코조아 세포 유형을 지도화했습니다. 각 세포 유형에는 특정 유전자 세트에서 발생하는 특정 역할이 있습니다. 이 세포 지도를 통해 이러한 유전자의 클러스터 또는 "모듈"을 지도화할 수 있습니다. 그런 다음 이러한 유전자 모듈을 제어하는 DNA의 조절 영역을 매핑하여 각 세포 유형의 역할과 이들이 함께 작동하는 방식에 대한 명확한 이해를 제공했습니다. 마지막으로, 그들은 이러한 세포 유형의 진화를 재구성하기 위해 종간 비교를 수행했습니다.
이러한 발견은 플라티플라스모산의 9가지 주요 세포 유형이 한 유형에서 다른 유형으로 전환되는 수많은 세포 유형에 의해 연결되어 있는 것으로 보인다는 것을 나타냅니다. 이 세포는 지속적으로 성장하고 분열하며 동물이 움직이고 먹는 데 필요한 세포 유형의 섬세한 균형을 유지합니다. 저자들은 또한 14가지 다른 유형의 폴리펩티드성 세포를 발견했지만, 이 세포들은 다른 모든 세포와 달리 중간 세포 유형이 없었고 성장이나 분열의 징후도 보이지 않았습니다.
놀랍게도, 이러한 폴리펩타이드성 세포는 수백만 년이 지나서야 양측성 동물과 같은 보다 발전된 동물에서는 나타나지 않았던 뉴런과 많은 유사점을 가지고 있습니다. 종간 분석에 따르면 이러한 유사점은 도라지에만 고유하며 해면동물이나 유인동물과 같은 다른 초기 계통군에서는 볼 수 없는 것으로 나타났습니다.
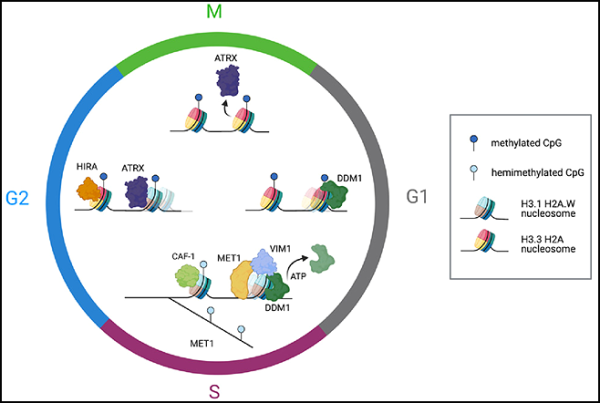
5. Cell: DDM1에 의한 히스톤 H3 변종의 크로마틴 리모델링은 식물 DNA 메틸화의 세대 간 후성유전적 유전을 가능하게 합니다.
유기체가 자신의 유전자를 자손에게 전달할 때, DNA에 있는 코드 이상의 것을 전달합니다. 일부 유기체는 세포에 이러한 코드를 사용하는 방법을 지시하는 화학적 태그를 전달하기도 합니다. 이러한 화학적 흔적이 미래 세대에게 전달되는 것을 후생적 유전이라고 합니다. 이것은 특히 식물에서 흔히 발생합니다. 결과적으로 이 분야의 주요 발견은 농업, 식량 공급 및 환경에 영향을 미칠 수 있습니다.
새로운 연구에서 미국 Cold Spring Harbor 연구소의 Rob Martienssen 교수와 Leemor Joshua-Tor 교수는 식물이 트랜스포손을 비활성 상태로 유지하는 화학적 태그를 전달하는 방법을 조사했습니다. 트랜스포존은 점핑 유전자라고도 합니다. 활성화되면 이리저리 움직이며 다른 유전자를 손상시킬 수 있습니다. 트랜스포존을 억제하고 게놈을 보호하기 위해 세포는 특정 DNA 부위에 조절 태그를 추가합니다. 이 과정을 메틸화라고 합니다. 관련 연구 결과는 Cell 저널에 2023년 9월 14일자 "Chromatin remodeling of histone H3 Variants by DDM1 Underlies Epigenetic Heritage of DNA methylation"이라는 제목으로 게재되었습니다.
2023, doi:10.1016/j.cell.2023.08.001
Martienssen과 Joshua-Tor는 이제 단백질 DDM1이 이러한 표시를 새로운 DNA 가닥에 추가하는 효소를 만드는 방법을 보여주었습니다. 식물 세포에는 DNA가 단단히 포장되어 있기 때문에 DDM1이 필요합니다. 게놈을 컴팩트하고 체계적으로 유지하기 위해 세포는 히스톤이라는 포장 단백질 주위에 DNA를 감쌉니다. "그러나 이것은 다양한 중요한 효소가 DNA에 접근하는 것을 방해합니다."라고 Martienssen은 설명합니다. 메틸화가 일어나기 전에 "히스톤을 제거하거나 밀어내야 합니다."
유전적 및 생화학적 실험을 통해, 이들 저자는 DDM1이 히스톤 H3.3을 히스톤 H3.1로 대체하는 것을 촉진한다는 사실을 발견했습니다. ddm1 돌연변이에서 DNA 메틸화는 H3.3 샤페론 HIRA의 손실로 인해 부분적으로 복원되는 반면, H3.1 샤페론 CAF-1은 필수가 됩니다. 단일 입자 저온 전자 현미경을 사용하여 그들은 DDM1이 뉴클레오솜으로 조립하는 데 필요한 아미노산 잔기 근처의 히스톤 H3.3과 변형되지 않은 히스톤 H4 꼬리에 결합한다는 것을 밝혔습니다. DDM1의 N 말단 자가억제 도메인은 효소 자체의 활성을 억제하는 반면, 헬리카제 도메인의 이황화 결합은 효소의 활성을 지원합니다. 세포 주기 동안 DDM1은 H3.1 및 H3.3 및 DNA 메틸트랜스퍼라제 MET1Dnmt1과 동일 위치에 위치하지만 H4K16 아세틸화에 의해 차단됩니다. 조슈아-토르(Joshua-Tor)는 "DDM1을 하나로 묶는 예상치 못한 열쇠는 실제로 수년 전에 발견된 최초의 돌연변이에 해당한다"고 말했습니다
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.