2023년 Disruption of SUV39H1-mediated H3K9 methylation sustains CAR T cell function
페이지 정보
작성자 PnH 조회130회 작성일 24-05-31 04:45본문
2023년 과학 혁신상과 표창 수상자 모두 CAR-T 세포 치료 분야의 선구적인 업적을 인정받아 (Carl June) 교수 와 (Michel Sadelain) 교수에게 수여 되어 노벨상 후보가 되었습니다.
Memorial Sloan Kettering Cancer Center에서 근무하는 동안 Michel Sadelain은 바이러스 벡터를 사용하여 인간 T 세포를 유전적으로 재조합하여 특정 항원 수용체를 발현하여 암세포를 표적으로 삼는 새로운 방법을 개발했습니다 .
이러한 연구는 후속 CAR-T 세포 치료의 기초를 마련했습니다.
2012년 Carl June 팀은 CAR-T 세포 치료법을 사용하여 급성 백혈병이 재발한 Emily라는 어린 소녀를 성공적으로 치료했습니다. 2017년 FDA는 최초의 CAR-T 세포 치료법을 승인했으며, 현재 6가지 CAR-T 세포 치료법이 FDA의 승인을 받았으며 수백 가지가 임상 시험 중에 있습니다.
CAR-T 세포치료제는 일명 '살아있는 세포치료제'로, 시험관 내에서 환자의 T세포를 생체공학적으로 조작해 종양 세포 표면의 항원을 인식한 뒤, 이 세포를 다시 환자 몸에 주입해 인식하는 효과를 발현합니다. CAR-T 세포치료제의 출현은 암 치료의 지형을 변화시켰으며, 기존 치료법에 비해 혈액종양에서 비교할 수 없는 치료 효과를 입증했습니다.
2023년 11월 7일, Memorial Sloan Kettering Cancer Center의 Michel Sadelain 팀은 암 분야 최고 저널인 Cancer Discovery 에 Disruption of SUV39H1-medium H3K9 methylation persists CAR T cell function이라는 제목의 연구 논문을 발표했습니다 .
이번 연구는 CAR-T 세포의 단 하나의 유전자인 SUV39H1 을 파괴하는 것만으로도 CAR-T 세포를 더욱 강력하게 만들고, CAR-T 세포 확장을 촉진하며, 피로를 예방하고, 종양과 더 오랫동안 싸울 수 있도록 돕는다는 것을 보여줍니다. 회귀. 이는 또한 CAR-T 세포의 후성유전적 프로그래밍이 기능과 지속성의 균형을 맞출 수 있는 잠재력을 갖고 있으며 입양 세포 치료를 개선하는 데 사용될 수 있음을 시사합니다.
논문의 공동 제1저자인 Nayan Jain 박사 는 CAR-T 세포가 단일 유전자를 손상시켜 기능을 유지하도록 도울 수 있다면 이는 광범위한 치료상의 이점을 가져올 것이라고 말했습니다 . 많은 암 환자들은 CAR-T 세포 치료를 받기 전에 여러 가지 화학요법 치료를 받았는데, 이로 인해 T 세포가 고갈되어 증식이 어려워 암과 효과적으로 싸우는 데 어려움을 겪습니다. 이번 연구에서 개발된 새로운 방법은 CAR-T 세포 수가 더 적고, 이 치료에 적합한 암 환자군을 확대할 수 있으며, 환자에 대한 치료 효과도 향상시킬 수 있습니다.
논문의 공동 제1저자인 Zhao Zeguo 박사 는 이 새로운 방법을 사용하면 CAR-T 세포의 수명을 연장하는 동시에 종양 살상 능력도 유지할 수 있으므로 더 낮은 용량을 사용하여 환자를 치료할 수 있다고 말했습니다 . 사이토카인 방출 증후군 (CRS) (CAR-T 치료의 가장 심각하고 흔한 부작용인 사이토카인 폭풍이라고도 함) 의 발생을 줄일 수 있습니다 .
치료 중 CAR-T 세포는 시간이 지남에 따라 기능을 잃는데, T 세포 고갈이라고 불리는 이 현상은 항상 CAR -T 세포 치료에 주요 장애물이었습니다.
Michel Sadelain 교수는 30년 전 처음으로 T 세포를 설계했으며 CAR-T 세포를 개선하기 위해 노력해 왔습니다. 그와 그의 팀의 초기 연구에서는 T 세포의 특정 유전자가 꺼지면 T 세포가 고갈된다는 사실이 밝혀졌습니다.
후생유전학을 DNA의 스위치에 비유할 수 있습니다. 스위치는 램프를 바꾸지 않고도 빛의 밝기를 변경합니다. 마찬가지로 후성유전학은 DNA 서열을 바꾸지 않고도 유전자 발현 수준을 바꿀 수 있습니다.
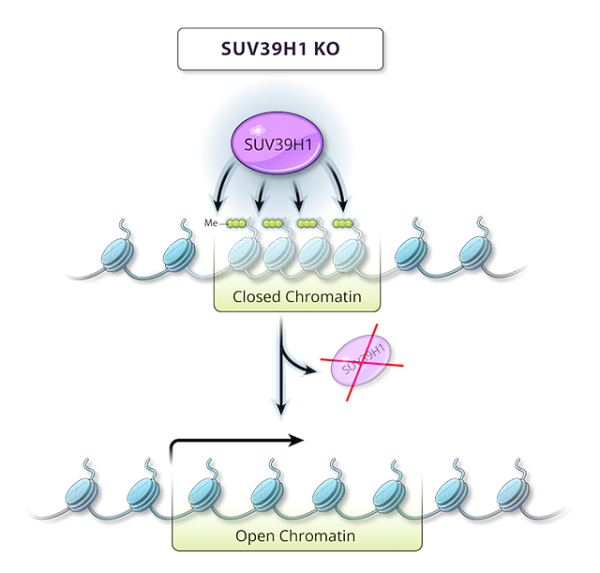
DNA가 세포핵에 포장되는 방식으로 인해 많은 후생유전학적 변화가 발생합니다. 염색체에서는 DNA의 이중 가닥이 히스톤이라는 단백질 로 둘러싸여 있는데 , DNA와 단백질이 빽빽하게 들어차 있는 영역에서는 유전자에 접근할 수 없고 발현을 시작할 수도 없습니다.
SUV39H1은 H3K9 메틸화를 매개하여 여러 유전자의 발현을 억제하는 H3K9 메틸트랜스퍼라제입니다. 연구팀은 이러한 모든 억제된 유전자의 발현을 바꾸려고 하기보다는 SUV39H1을 파괴하는 데 집중하여 T세포 기능을 향상시키기 위해 SUV39H1이 억제하는 여러 유전자의 발현을 동시에 미세 조정하는 것이 더 낫다고 믿고 있습니다.
연구팀은 CRISPR-Cas9 유전자 편집 기술을 이용해 인간 CAR-T 세포의 SUV39H1 유전자를 녹아웃시킨 뒤, 이 유전자 편집 CAR-T 세포를 백혈병 세포나 전립선 암 세포를 이식한 쥐에 주입했습니다. 그 결과, 두 암 모두 유전자 편집 CAR-T 세포가 소모 없이 기능을 유지할 수 있어 종양이 완전히 제거되는 것으로 나타났습니다. 대조적으로, 유전자 편집 CAR-T 세포 없이 치료된 종양의 모델은 생존하지 못했습니다.
또한 연구팀은 유전자 편집 CAR-T 세포의 지속성을 검증하기 위해 치료받은 쥐를 새로운 종양에 노출시켰는데, 그 결과 SUV39H1 유전자를 제거하는 CAR-T 세포가 종양 재발을 예방할 수 있는 것으로 나타났습니다.
실험 모델을 대상으로 실시된 이 전임상 연구에서는 SUV39H1 유전자를 녹아웃시키는 CAR-T 세포가 더 강력하고 지속적인 항종양 효과를 나타낼 뿐만 아니라 심각한 부작용도 발견하지 못했다는 사실이 입증되었습니다. 또한 연구팀은 이번 연구를 바탕으로 임상시험을 진행하기 위해 생명공학기업 엠네모 테라퓨틱스(Mnemo Therapeutics) 에 해당 기술을 라이선스를 신청했습니다.
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.