2024년 3월 면역세포 동향
페이지 정보
작성자 PnH 조회137회 작성일 24-05-31 06:50본문
1. Science Immunology:Structural principles of peptide-centric chimeric antigen receptor recognition guide therapeutic expansion
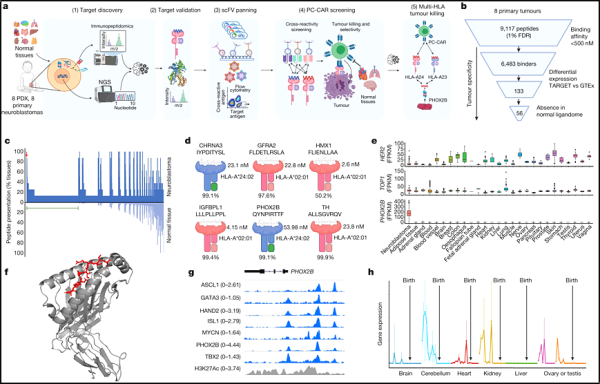
키메라 항원 수용체(CAR)는 종양 세포를 죽이는 표적 치료법을 전달하는 능력으로 인해 희귀하고 치료가 어려운 암에 대한 흥미롭고 새로운 치료 영역을 열었습니다. 펩타이드 중심 CAR(PC-CAR)은 세포 내 잠재적인 종양유전자에 의해 생성된 단백질의 특정 펩타이드 "바코드"에 의존하여 암세포를 찾아 표적화하는 것을 목표로 합니다. 이러한 펩타이드 바코드는 인간 백혈구 항원(HLA)에 의해 표시되어 면역 체계가 자체 단백질과 바이러스와 같은 외부 침입자를 구별하는 데 도움이 됩니다. 그러나 HLA는 기본 기능을 수행하는 단백질을 암호화하는 DNA인 25,000개 이상의 대립 유전자를 가진 가장 "다형성" 유전자에서 파생됩니다. HLA는 서로 다를 수 있어 다양한 암과 관련된 표적을 설계하기가 어렵습니다. PC-CAR.
Nature, 2023, doi: 10.1028/s41586-023-06706-0
이제 새로운 연구에서 필라델피아 아동 병원의 연구자들은 PC-CAR이 이러한 HLA 복합체의 "세포"을 인식하는 방법을 설명하는 3차원 단백질 구조를 풀었습니다. 이러한 구조적 정보를 통해 사람들은 CAR이 다양한 다형성 HLA 대립유전자에서 종양 관련 항원을 어떻게 인식하는지 이해할 수 있게 되어 더 복잡하고 치료하기 어려운 종양에 대한 정밀 의학 전략을 설계 할 수 있는 더 많은 가능성을 제공할 것입니다.
관련 연구 결과는 '사이언스 면역학(Science Immunology)' 2023년 12월호에 '구조적 원리의 펩타이드 중심 키메라 항원 수용체 인식 가이드 치료 확장'이라는 제목으로 게재됐습니다.
논문의 교신저자이자 필라델피아 아동병원 전산 및 게놈 의학 센터 부교수인 니콜라오스 G. 스구라키스(Nikolaos G. Sgourakis) 박사는 "CAR이 특정 암과 관련된 특정 대립 유전자를 표적으로 삼는 데 적절하게 일치하지 않으면, "치료적 이점을 제공하지 않고 독성을 유도합니다. 3차원 복잡한 구조를 관찰함으로써 우리는 이러한 발견을 사용하여 여러 HLA를 표적으로 삼을 수 있는 CAR을 설계함으로써 치료 설계의 효율성을 향상시킬 수 있습니다."
초기 CAR 치료법은 종양 세포 표면의 암 특이적 항원만을 표적으로 삼을 수 있었으며, 이러한 항원의 대부분은 세포 내에도 존재합니다. 그러나 이전에 접근할 수 없었던 이러한 표적은 결국 세포 표면에 "바코드"처럼 제시될 수 있는 펩타이드로 분해되어 치료 표적이 되는 것으로 밝혀졌습니다. 그럼에도 불구하고 HLA 대립유전자는 매우 가변적이기 때문에 CAR 치료법은 종양 세포 표면에 어떤 펩타이드가 제시되는지에 따라 종양 환자의 소수에만 도움이 될 수 있습니다.
2. Nature Biomedical Engineering:Modular chimeric cytokine receptors with leucine zippers enhance the antitumour activity of CAR T cells via JAK/STAT signalling
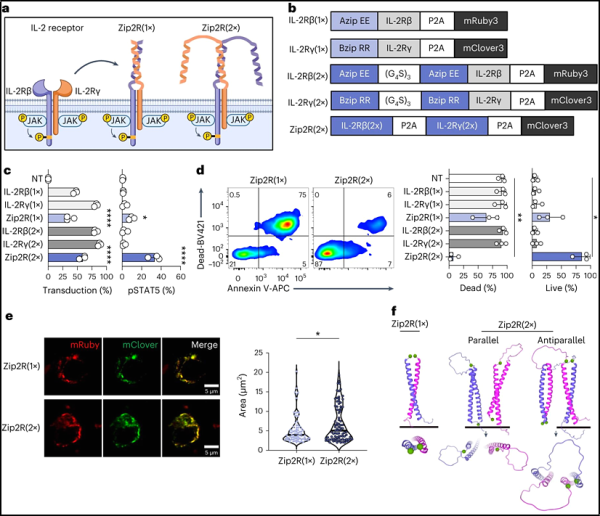
변형된 키메라 항원 수용체(CAR) T 세포(CAR-T)를 사용한 면역요법은 재발성 백혈병 아동의 생존율을 크게 향상시켰습니다. 그러나 이러한 치료법은 고형 종양 치료에는 효과적이지 않으며 독성이 매우 높을 수 있습니다. 미국 세인트 주드 아동 연구 병원 연구진은 새로운 연구에서 CAR-T 세포에 모듈형 키메라 사이토카인 수용체를 추가하면 다중 고형 종양 모델에서 효능이 향상된다는 사실을 발견했습니다.
관련 연구 결과는 2023년 11월 30일 Nature Biomedical Engineering 저널에 온라인으로 게재되었습니다. 이 논문의 제목은 "류신 지퍼가 있는 모듈형 키메라 사이토카인 수용체가 JAK/STAT 신호를 통해 CAR T 세포의 항종양 활성을 향상시킵니다"입니다.
Nature Biomedical Engineering 2023, doi:10.1038/s41551-023-01143-w
논문의 제1저자인 매튜 벨(Matthew Bell)은 "우리는 모듈형 키메라 사이토카인 수용체를 설계했고 이것이 CAR-T 세포를 개선한다는 것을 입증했습니다. 우리의 모델로 판단하면 이 기술은 CAR-T 세포 치료를 광범위하게 개선할 수 있는 잠재력을 가지고 있습니다."라고 말했습니다.
CAR-T 세포는 암세포를 표적으로 삼아 죽이도록 변형된 환자 자신의 면역세포입니다. 고형 종양에서 생성된 항면역 신호는 CAR-T 세포를 차단하여 치료 효과를 감소시킬 수 있습니다. 이 문제를 해결하기 위해 과학자들은 CAR-T 세포와 사이토카인 주사를 결합하는데, 이는 예상치 못한 심각한 독성을 유발할 수 있습니다. 이들 저자가 개발한 새로운 방법을 통해 사이토카인의 친면역 신호를 CAR-T 세포에만 전달하여 전신 독성을 제거할 수 있었습니다.
Bell은 "우리의 접근 방식은 사이토카인 신호 전달의 효과를 변형된 CAR-T 세포에만 제한합니다. 이는 결국 사이토카인 관련 독성 가능성을 줄이고 이러한 CAR-T 세포에 억제 활성을 억제하는 능력을 제공합니다."라고 말했습니다. "종양 미세환경에서 효과적으로 기능하는 데 필요한 신호입니다."
3. Cell Reports Medicine:GRP78-CAR T cell effector function against solid and brain tumors is controlled by GRP78 expression on T cells
새로운 연구에서 미국 세인트 주드 아동 연구 병원(St. Jude Children's Research Hospital)의 연구자들은 암 면역요법을 뇌종양과 같은 고형 종양 치료에 한 단계 더 가까이 다가섰습니다. 그들은 원리 증명 실험에서 GRP78 단백질을 표적으로 하는 세포 면역요법을 시연했습니다.
관련 연구 결과는 2023년 11월 21일 Cell Reports Medicine 저널에 게재되었습니다. 논문 제목은 "고형 및 뇌종양에 대한 GRP78-CAR T 세포 이펙터 기능은 T 세포에서 GRP78 발현에 의해 제어됩니다."
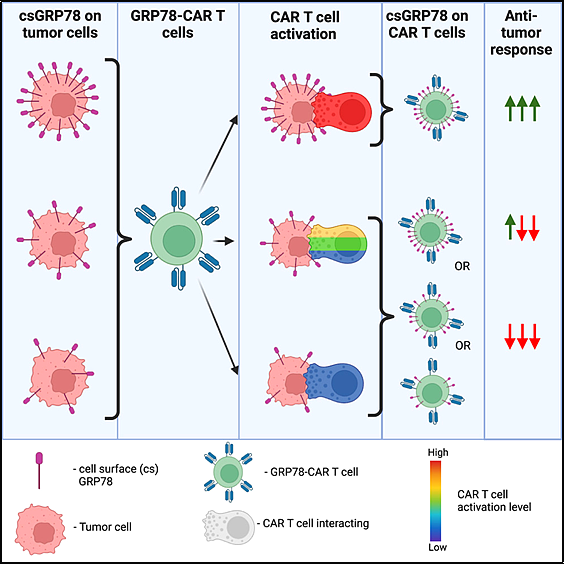
Cell Reports Medicine 2023, doi:10.1016/j.xcrm.2023.101297
저자들은 또한 특정 종양이 암을 죽이는 면역 세포를 속여 GRP78을 발현하도록 속여 면역 세포를 차단하거나 죽게 만드는 저항 메커니즘도 발견했습니다. 이 발견은 GRP78을 발현하는 다양한 난치성 뇌 및 고형 종양을 표적으로 하는 면역요법의 개발에 중요한 의미를 갖습니다.
논문의 공동 교신저자이자 세인트 주드 아동 연구 병원 골수 이식 및 세포 치료과인 Giedre Krenciute 박사는 "우리는 GRP78이 CAR-T 세포의 좋은 표적이라는 것을 발견했습니다. 우리는 여러 연구를 했습니다. "성인 교모세포종, 미만성 내생 교교종(DIPG), 골육종 , 삼중 음성 유방암 , 유잉 육종 등 여러 암에서 더 높은 GRP78 발현이 관찰되었지만 우리의 효능은 다양했습니다."
이들 저자가 개발한 GRP78 표적 CAR-T 세포는 세포 모델과 마우스 모델 모두에서 여러 유형의 암을 성공적으로 죽였으나 상당한 차이가 있었습니다. 그들은 GRP78의 수준이 높을수록(표적할 단백질이 많아짐) CAR-T 세포가 암을 찾아 파괴하는 것이 더 쉬워질 것이라고 예상했지만, 사실은 그렇지 않았습니다. 그들은 GRP78의 양과 CAR-T 세포의 암을 죽이는 능력 사이에는 아무런 관련이 없음을 발견했습니다.
4. Annals of Internal Medicine:Second-Line Chimeric Antigen Receptor T-Cell Therapy in Diffuse Large B-Cell Lymphoma
키메라 항원 수용체 T세포치료제(CAR-T) 악시카브타진 실로류셀(axi-cel)과 리소카브타진 마라루셀(liso-cel)이 미만성 거대 B세포 림프종(DLBCL) 환자에게 효과적이지 않다는 새로운 연구 결과가 나왔습니다.
관련 연구 결과는 '미만성 거대 B세포 림프종의 2차 키메라 항원 수용체 T세포 치료'라는 제목으로 내과학회지(Annals of Internal Medicine)에 2023년 12월 5일 온라인 게재됐습니다.
Amar H. Kelkar, MD, Dana-Farber Cancer Institute 및 동료들은 상태 전이 마이크로시뮬레이션 모델에서 DLBCL의 비용 효율성을 통해 2차 CAR-T 세포 치료법과 구제 화학면역 치료법 및 통합 자가 줄기 세포 이식(ASCT)을 연구했습니다. 표적 모집단은 DLBCL에 걸린 "고위험" 환자입니다.
5년에 걸쳐 고위험 환자에게 CAR T세포 치료법을 시행하면 미국 의료 지출이 약 68억 달러 증가할 것입니다.
5. Molecular Cancer: Safety and efficacy of a novel anti-CD19 chimeric antigen receptor T cell product targeting a membrane-proximal domain of CD19 with fast on- and off-rates against non-Hodgkin
lymphoma: a first-in-human study
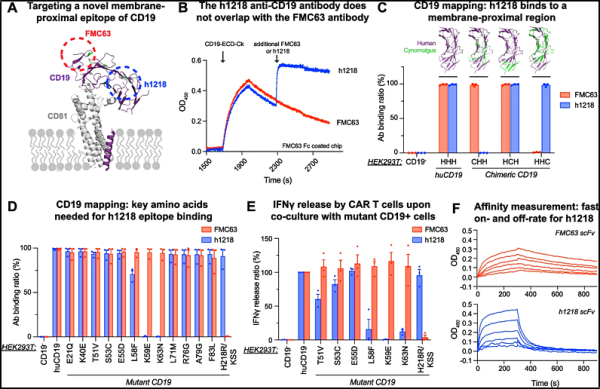
AT101은 새로운 유형의 CAR-T 세포치료제로서 독특한 결합 메커니즘을 이용해 CD19를 표적으로 합니다. 새로운 연구에서, 펜실베니아 대학의 연구자들은 임상 시험에서 연구된 더 높은 용량 수준에서 100% 완전 반응률을 보여주는 AT101의 1상 임상 시험의 초기 결과를 지적했습니다. 관련 연구 결과는 2023년 12월 9일 Molecular Cancer 저널에 게재되었습니다. 논문 제목은 "빠른 온/오프로 CD19의 막 근위 도메인을 표적으로 하는 새로운 항-CD19 키메라 항원 수용체 T 세포 제품의 안전성 및 효능"입니다. ”
2023, doi:10.1186/s12943-023-01886-9
CAR-T 세포 치료법은 다른 치료 옵션이 부족한 많은 혈액암 환자들의 치료에 혁명을 일으켰습니다. 일부 환자는 CAR-T 세포 치료에 대해 장기적인 반응을 보이는 반면, 다른 환자는 그렇지 않거나 결국 암이 재발합니다. 현재 승인된 CD19 CAR-T 세포 치료법은 모두 동일한 에피토프(FMC63)(이하 FMC63-CART19)를 통해 CD19를 표적으로 합니다.
더 많은 환자들에게 CD19 CAR-T 세포치료제의 효과를 높이기 위해 펜실베니아대학교 혈액종양학 조교수인 마르코 루엘라(Marco Ruella) 박사 연구팀은 한국 기업인 앱클론(AbClon)과 협력해 CAR-T 세포치료제를 개발했습니다. T 세포 제품(AT101): AT101은 새로운 유형의 항체(이하 h1218-CART19)를 통해 세포막 근처에 위치한 CD19의 다른 에피토프(h1218)를 표적으로 합니다.
전임상 연구에서 이들 저자는 h1218-CART19가 FMC63-CART19에 비해 T 세포 고갈을 감소시키고 질병 통제를 개선한다는 것을 입증했습니다.
이 최초의 인간 대상 임상 1상 시험(NCT05338931)은 한국에서 진행되었으며 재발성 또는 불응성 B세포 비호지킨 림프종 환자 12명이 등록했습니다. 이번 연구는 처음 6명의 환자에서 안전성이 확인됨에 따라 AT101의 용량 수준을 높이는 것을 목표로 하고 있습니다. 중앙값 6.5개월의 추적관찰 후에 2단계 이상의 치료를 받은 6명의 환자 모두 완전 관해를 달성했으며 암이 재발하지 않았습니다.
6. Blood:A Phase 1 Dose Escalation Trial of Third-Generation CD19-Directed CAR T-Cells Incorporating CD28 and Toll-like Receptor 2 (TLR2) Intracellular Domains for Relapsed or Refractory B-Cell Non-Hodgkin Lymphomas (ENABLE)
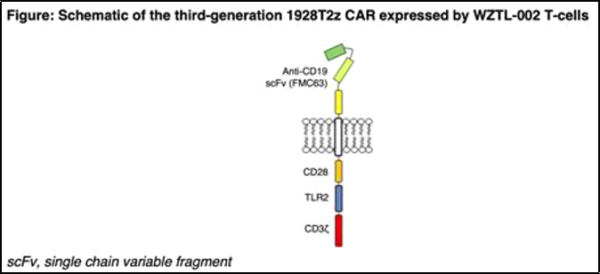
새로운 연구에서 뉴질랜드의 Malahan Institute of Medical Research와 Wellington Zhaotai Therapies Limited의 연구원들은 새로운 3세대 항-CD19 키메라 항원 수용체(CAR) T 세포(항-CD19 CAR-T 세포) 치료법 1상 용량 증량 임상을 공개했습니다.
관련 연구 결과는 2023년 11월 28일 Blood 저널에 온라인으로 게재되었습니다. 논문 제목은 "CD28 및 TLR2(Toll-like Receptor 2) 세포 내를 포함하는 3세대 CD19-지정 CAR T-세포의 1상 용량 증가 시험"입니다.
Blood, 2023, doi:10.1182/blood-2023-178872
axicabtagene ciloleucel 및 brexucabtagene autoleucel과 같은 CD28 공동자극 도메인을 갖는 항-CD19 CAR-T 세포는 B 세포 비호지킨 림프종 치료에 가장 효과적인 CAR-T 세포 치료법 중 하나이지만 수용자의 약 절반은 신경 독성(면역 효과기) 세포 관련 신경독성 증후군(ICANS, 면역 효과기 세포 관련 신경독성 증후군)이 발생하고, 수혜자의 최대 90%에서 사이토카인 방출 증후군(CRS)이 발생합니다.
이들 저자는 CD28과 TLR2 공동자극 도메인을 결합한 3세대 자가 항CD19 CAR-T 세포 제품을 개발했습니다. 전임상 연구에서 TLR2 공동자극 도메인을 추가한 항CD19 CAR-T 세포 제품은 CD28 공동자극만 한 CAR에 비해 염증성 사이토카인인 IFN-γ와 GM을 감소시키면서 효능을 유지하거나 개선한 것으로 나타났습니다.
재발성 또는 불응성 B세포 비호지킨 림프종 환자 21명이 1상 임상 시험의 용량 증량 코호트에서 치료를 받고 1차 추적 기간을 완료했습니다. 환자의 평균 연령은 57세였고, 19%는 마오리족이었으며, 이전에 평균 4번의 치료를 받았습니다.
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.