2024년 Nature Biotechnology:In vivo human T cell engineering with enveloped delivery vehicles
페이지 정보
작성자 PnH 조회118회 작성일 24-05-31 06:19본문
2024년 Nature Biotechnology:In vivo human T cell engineering with enveloped delivery vehicles
새로운 연구에서 버클리 캘리포니아 대학의 연구원들은 새로운 CRISPR-Cas9 정밀 표적 전달 방법을 개발했습니다.
CRISPR-Cas9와 관련된 치료법을 포함하여 현재 승인된 대부분의 유전자 치료법은 신체 외부에서 제거된 세포의 유전자 편집을 포함하고 편집된 세포를 환자에게 다시 주입하는 것입니다.
이 기술은 혈액 세포를 표적으로 삼는 데 이상적 이며, 화학요법으로 인해 환자의 골수가 손상된 후 유전자 편집 혈액 세포를 재프로그래밍하는 적혈구 과 같은 혈액 질환을 치료하기 위해 새로 승인된 CRISPR 유전자 치료법입니다
이제 새로운 연구에서 버클리 캘리포니아 대학의 연구원들은 환자의 매우 특정한 세포 하위 집단에 대해 유전자 편집을 수행할 수 있는 새로운 CRISPR-Cas9 정밀 표적 전달 환자에게 유전자 편집 혈액 세포를 주입하기 전에 환자의 골수와 면역 체계를 파괴할 필요는 없습니다.
관련 연구 결과는 'In vivo human T cell Engineering with Enveloped Delivery Vehicle'이라는 제목으로 네이처 바이오테크놀로지(Nature Biotechnology) 저널에 2024년 1월 11일자 온라인 게재됐습니다.
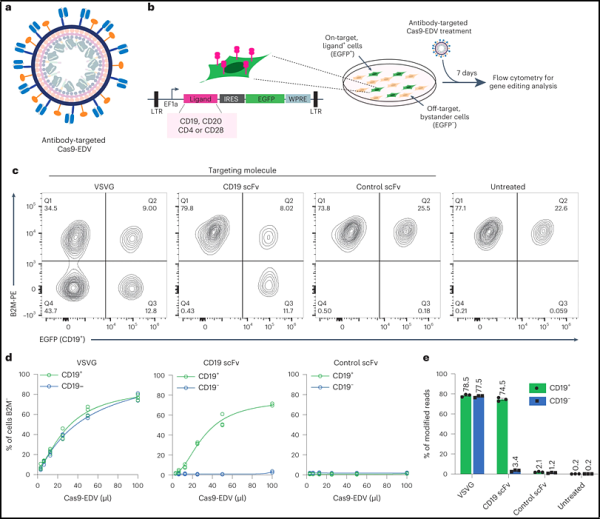
CRISPR-Cas9 게놈 편집 기술의 공동 발명자인 Jennifer Doudna는 버클리 캘리포니아 대학교 연구실에서 Cas9 편집 단백질과 가이드 RNA(gRNA)를 막으로 장식된 단일클론 항체 단편에 감싸는 전달 방법을 개발했습니다. 소포체이며 이러한 단클론 항체 조각은 특정 유형의 혈액 세포를 표적으로 삼을 수 있습니다.
다우드나 연구실의 CRISPR 연구원인 제니퍼 해밀턴(Jennifer Hamilton)은 키메라 항원 수용체(CAR) T세포 치료법이라는 혁명적인 암 치료법의 출발점이 되는 T세포라고 불리는 면역 체계의 세포 유형을 표적으로 삼아 이를 입증했습니다.
해밀턴과 연구원들은 인간화 면역 체계를 갖춘 살아있는 쥐를 치료하여 인간 T 세포를 CAR T 세포 로 전환시켰고 , 이를 통해 B 세포라고 불리는 또 다른 유형의 면역 세포를 표적으로 삼아 제거할 수 있었습니다.
"우리의 접근 방식은 표적 분자의 다중화를 포함합니다. 즉, 막 기포에 두 개 이상의 표적 분자가 있고 표적 세포와의 상호 작용은 컴퓨터의 AND 게이트와 약간 비슷합니다."라고 해밀턴은 말했습니다.
Nature Biotechnology, 2024, doi:10.1038/s41587-023-02085-z
"서로 상호작용하는 두 개의 항체 리간드를 사용하여 막 소포를 결합시키면 보다 효율적인 전달을 얻을 수 있습니다. T 세포 표적화 벡터로 마우스를 처리한 후 우리가 관심 있는 세포 유형인 T 세포에서는 간세포가 아니라 게놈 편집이 관찰되었습니다.”
해밀턴과 그녀의 팀은 유전자 치료법을 제공하기 위한 여러 실험 기술 중 하나를 연구하고 있습니다. 이러한 기술 중 다수는 외피가 있는 바이러스의 껍질을 사용합니다. 즉, 바이러스의 속이 비어 있고 CRISPR-Cas9와 같은 교정 이식 유전자 또는 유전자 편집 도구로 채워져 있습니다.
해밀턴은 박사 과정에서 인플루엔자 바이러스와 같은 외피 바이러스를 연구했는데, 그녀의 연구는 이러한 바이러스가 더 유연한 외부 껍질을 갖도록 유전적으로 변형하는 데 중점을 두었습니다.
그녀는 2021년 논문에서 HIV-1 바이러스의 외부 껍질을 비우고 Cas9로 채운 후 시험관 내에서 배양된 T 세포를 편집하여 CAR-T 세포로 전환할 수 있음을 확인했습니다. 그 이후로 그녀는 바이러스 봉투에 큰 변화를 가져왔고 이제는 이를 (EDV)이라고 부릅니다.
EDV의 중요한 측면은 외부 봉투가 여러 항체 단편 또는 표적화 리간드로 쉽게 장식될 수 있어 표적 특이성을 크게 향상시킬 수 있다는 것입니다. 아데노 관련 바이러스 및 지질 나노입자와 같은 다른 유전자 전달 수단은 정확한 표적화를 달성하기가 더 어렵다는 것이 입증되었습니다.
해밀턴은 "사람들은 이러한 모든 벡터를 한 가지 세포 유형에 특이적으로 만들고 다른 세포 유형으로의 유전자 전달을 방지하기 위해 모든 벡터를 재표적화하려고 노력하고 있습니다. 지금까지 해왔던 것처럼 항체나 항체 단편을 표시할 수 있지만 방관 세포는 그렇지 않습니다."라고 말했습니다. 흡수율은 여전히 높습니다. 한 가지 세포 유형에 전달을 편향시킬 수 있지만 여전히 방관자 세포 흡수를 관찰할 수 있습니다. 우리 논문에서 우리는 실제로 간을 관찰하여 표적을 벗어난 사건이 있는지 확인했지만, 그렇지 않았습니다. 나는 보다 전통적인 비외피 바이러스 벡터나 지질 나노입자를 사용하여 그렇게 하는 것이 더 어렵다고 생각합니다."
논문에서 해밀턴과 그녀의 동료들은 암 환자에게 사용되는 성공적인 생체 외 CRISPR CAR-T 세포 치료법을 생체 내에서 복제하려고 했습니다. 이 치료법은 암세포를 표적으로 하는 수용체를 코딩하는 이식유전자를 전달할 뿐만 아니라 CRISPR 기술을 사용하여 암세포를 표적으로 하지 않는 수용체를 녹아웃시킵니다.
저자들은 성공적으로 고유 T 세포 수용체를 제거하고 B 세포를 표적으로 하는 수용체를 코딩하는 이식 유전자를 전달했습니다. Cas9 단백질은 도입유전자와 동일한 EDV에서 전달되기 때문에 Cas9 유전자를 전달하는 방법보다 수명이 짧으며 이는 표적을 벗어난 편집이 적다는 것을 의미합니다.
해밀턴 교수는 “이번 논문에서 이루고자 하는 것은 세포 외부에서 유전자 편집을 하는 전 단계를 건너뛰는 것”이라며 “우리의 목표는 두 유전자를 모두 전달할 수 있는 벡터를 체계적으로 전달하는 것이며 특정 세포에서만 유전자 녹아웃이 이루어진다”고 말했습니다. 우리는 유전자 편집 CAR-T 세포를 만드는 복잡한 과정을 단순화하기를 희망하면서 이 전달 전략을 사용하여 생체 내에서 유전자 편집 CAR-T 세포를 만듭니다."
Doudna와 그녀의 연구실은 EDV 매개 전달의 효율성을 계속해서 향상시킬 것입니다.
출처입니다
Jennifer R. Hamilton et al. In vivo human T cell engineering with enveloped delivery vehicles. Nature Biotechnology, 2024, doi:10.1038/s41587-023-02085-z.
Highly targeted CRISPR delivery system advances gene editing in living animals
안녕하세요 PnH 입니다
저희 PnH 는 기존의 폐쇄적이고 의존적이였던 암정보에서 벗어나,
원하면 누구나 언제든 찾을 수 있도록 '입증된 암정보의 공개'를 목표로 하고있습니다.
저희 PnH 는 전세계의 암환자분들에게 효과적이고, 입증된 암치료정보를 제공하며
루테시움, CAR-T 카티, TCR-T 티시알티, TIL 틸, 표적치료, 면역치료 등
신뢰도 높은 치료정보와, 검증된 논문을 직접 번역하여 제공하고 있습니다.
(때문에 자료의 불펌은 금지합니다.)
암종별 연구, 치료법, 임상 소식을 누구보다 빠르게 제공해 드리며
환자 스스로 정보를 제대로 알고, 찾고, 이해하실 수 있도록 많은 정보를 제공하기 위해 최선을 다하겠습니다.
감사합니다.